Метиленовый синий (синька)
Модераторы: Бегущая вода, МИА, Медовая Пчёлка, Елизавета Юрьевна, Алёна ( Aqua pura ), Екатерина_, Оkсанa, Елена25, Yanny
Сообщений: 43
• Страница 1 из 3 • 1, 2, 3
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Метиленовый синий (синька)
«Синька» против коронавируса.
https://trends.rbc.ru/trends/innovation ... 4cf7f7bb35
Раствор красителя метиленовый синий, известный в народе как «синька», может уничтожать коронавирус в организме человека. К такому выводу пришли российские ученые из Сеченовского университета
В ходе экспериментального лечения пациенты с диагнозом COVID-19 и разной степенью поражения легких полностью выздоровели. В группе добровольцев, принимавших метиленовый синий с целью профилактики, никто не заболел. Значит ли это, что эффективное лекарство от новой болезни наконец найдено?
Долгие месяцы мы наблюдаем за тем, как ВОЗ и представители Big Farma по всему миру ищут эффективное лекарство от COVID-19. Поскольку создание нового препарата — дело не быстрое, а людей по всему миру необходимо лечить, было разрешено применять некоторые медикаменты off-label, то есть не по назначению. И нашумевший гидроксихлорохин, и фавилавир, и многие другие лекарства, которые применялись и применяются для лечения коронавирусной инфекции, создавались для совершенно других болезней. Многие из них трудно купить, а некоторые еще и довольно дорогие.
И вот на фоне непростой ситуации с лечением COVID-19 приходит новость о том, что синий краситель — старое и копеечное медицинское средство (около 8 руб. за дозу), оказывается, может эффективно лечить коронавирусную инфекцию. Вещество убивает сам вирус, восстанавливает многие функции организма и борется с последствиями болезни. Неужели это правда? Научные изыскания на текущий момент (июль 2020 года) говорят — похоже, что так.
Знакомьтесь, метиленовый синий
У пресловутой «синьки» солидное научное реноме. Вещество было синтезировано в 1877 году и изначально применялось в медицине и промышленности как краситель и пигмент. Но позже выяснилось, что метиленовый синий (МС) обладает широким спектром терапевтических свойств.
• С XIX века и по настоящее время МC применяется как противомалярийный препарат. Он одинаково эффективен против всех видов этого паразитарного заболевания.
• МС — одно из первых лекарств, которое успешно применяли для лечения психозов, биполярного и нейродегенеративных расстройств, в том числе деменции и болезни Альцгеймера.
• МС считается эффективным лекарством от метгемоглобинемии — состояния, при котором в крови повышается содержание метгемоглобина (окисленного гемоглобина) и развивается тканевая гипоксия.
• МС входит в список жизненно-важных препаратов по версии Всемирной организации здравоохранения как антидот при отравлении цианидами, угарным газом и сероводородом.
• МС — мощный антиоксидант https://pubmed.ncbi.nlm.nih.gov/28840449/ , который способен блокировать окислительный каскад в организме.
• МС — противовоспалительное средство широкого спектра действия.
• МС обладает и ярким противовирусным эффектом. В 2018 году было доказано https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7169708/ , что метиленовый синий инактивирует в плазме крови вирус Эбола и коронавирус MERS-CoV, вызывающий острый ближневосточный респираторный синдром.
Помимо этого, раствор метиленового синего известен как фотосенсибилизатор. Это группа светочувствительных веществ, действие которых усиливается при воздействии света с соответствующей длиной волны. Фотосенсибилизатор переносит энергию света на кислород, благодаря чему он переходит в так называемое синглетное состояние. Синглетный кислород химически очень активен: он окисляет белки и другие биомолекулы, разрушая внутренние структуры патологических клеток, после чего они становятся нежизнеспособными.
Такое свойство фотосенсибилизаторов позволило успешно применять их в фотодинамической терапии при лечении онкологических заболеваний.
Метиленовый синий против SARS-CoV-2: как родилась идея?
Идея родилась в Институте кластерной онкологии имени Л.Л. Левшина на базе Университетской клинической больницы № 1 Сеченовского университета.
В разгар эпидемии коронавируса, как и многие другие медицинские учреждения в Москве, институт был перепрофилирован под ковидный госпиталь. На тот момент уже существовал список рекомендованных лекарств и протокол лечения одобренный Минздравом России, но сеченовские онкологи все равно задумались о поиске альтернативных методов лечения.
Об эксперте: Артем Ширяев — кандидат медицинских наук, врач-хирург, онколог Института кластерной онкологии имени Л.Л. Левшина Сеченовского университета.
«Поскольку мы совместно с физиками из Института общей физики РАН давно и успешно применяем фотодинамические методы для лечения онкологических больных, то сразу вспомнили об известном фотосенсибилизаторе — метиленовом синем. Он как раз находился у нас в разработке по проекту фотодинамической терапии опухолей мозга. Уже были опубликованы работы российских и зарубежных ученых, подтверждающие способность синего красителя уничтожать некоторые патогенные вирусы в плазме крови при воздействии красного света. И пока мы продумывали, как применить этот опыт к истории с COVID-19, вышла публикация китайских ученых. В статье был описан успешный опыт инактивации вируса SARS-CoV-2 в плазме крови инвитро (то есть в пробирке) с применением светового облучения при различных дозировках метиленового синего. Вирус погибал за считанные минуты при воздействии метиленового синего и за считанные секунды при дополнительном облучении красным светом. Эта работа помогла нам разработать свой протокол лечения. Первыми добровольцами, принявшими метиленовый синий были: я сам, академик РАН и директор Института кластерной онкологии Игорь Решетов, а также профессор Института общей физики РАН Виктор Лощенов. Его лаборатория разрабатывает для нас оборудование для фотодинамической терапии».
По словам хирурга-онколога Ширяева, никакого страха перед приемом метиленового синего не было — препарат давно зарекомендовал свою безопасность. К тому же ученым нужно было точно рассчитать дозу, способную убивать вирус; понять, как это вещество будет выводиться из организма; и спроектировать лазерную установку для проведения фотодинамической терапии.
Об эксперте: Виктор Лощенов — доктор физико-математических наук, профессор Института общей физики им. А.М. Прохорова РАН.
«Когда мы начали эту работу, пандемия была в разгаре. Все в Москве сидели на самоизоляции. Я не мог работать в своей лаборатории, поэтому все подготовительные исследования проводил у себя дома. Я исследовал фармакокинетику метиленового синего на себе и добровольцах и параллельно осуществлял разработку облучателя. В последствии лазерные установки со световой мощностью десятикратно превышающей существующие аналоги, были созданы студентами-выпускникам Института общей физики. Они поставили у себя в общежитии 3D-принтеры, закупили комплектующие и с их помощью «напечатали» четыре облучателя».
После того как и оборудование, и протокол лечения были готовы, ученые подали заявку в независимый локальный комитет по этике Первого Московского государственного медицинского университета имени И.М. Сеченова Минздрава России.
Исследование было утверждено 24 апреля 2020, уже на следующий день экспериментальное лечение метиленовым синим было предложено испытать на себе пациентам с коронавирусной инфекцией. Как ни странно, многие охотно согласились.
Как проходило испытание метиленового синего на больных COVID-19
Исследование проводилось с 25 апреля по 24 мая 2020. В нем приняло участие 43 пациента с подтвержденным диагнозом COVID-19 и 39 добровольцев. В последнюю группу вошли люди с высоким риском заражения — врачи, работавшие в «красной зоне», взрослые члены их семей и ученые, участвовавшие в разработке исследования.
Все добровольцы принимали препарат еженедельно, выпивая индивидуально рассчитанную дозу метиленового синего, разведенного в стакане воды. Фотодинамическая терапия в группе добровольцев не применялась.
Среди 43 пациентов были люди с разной степенью тяжести заболевания и с разной степенью поражения легких: от 25 до 75% по результатам компьютерной томографии. Все они помимо стандартного симптоматического лечения получали метиленовый синий в виде ингаляций и перорально в сочетании с фотодинамической терапией.
С помощью спроектированной светодиодной установки врачи воздействовали красным светом с длиной волны 665 нм на зону носоглотки и груди каждого пациента. При таком воздействии метиленовый синий усиливает свою активность почти в десять раз.
Эффект от лечения наступал быстро. Уже на следующий день у многих пациентов температура спадала с 39°С до 36,6°С. Полностью возвращалось утраченное обоняние. Люди отмечали общее улучшение самочувствия и восстановление функций дыхания. У многих исчезали боли в грудной клетке.
К реанимационным больным возвращалась способность дышать самостоятельно, поднимался уровень сатурации (насыщение крови кислородом). Наблюдалась положительная динамика по КТ — исчезал эффект матового стекла.
После однократного ингаляционного применения метиленового синего с сопутствующей фотодинамической терапией уже на следующий день ПЦР-тест на SARS-CoV-2 у всех пациентов был отрицательным. Вирус был полностью элиминирован из организма.
На 10 и 12 день после госпитализации повторный ПЦР-тест тоже не обнаруживал вирус ни у одного из участников исследования, включая группу добровольцев.
За все время проведения исследования ни у одного из испытуемых не было выявлено никаких побочных эффектов на препарат метиленовый синий.
Как относиться к результатам исследования?
Директор Института кластерной онкологии Сеченовского университета и академик РАН Игорь Решетов считает, что потенциал у метиленового синего любопытный. Возможно, он будет иметь свою точку приложения в лечении острых респираторных инфекций, например, на старте болезни. Но прежде, чем уверенно говорить о каких-то противовирусных эффектах препарата, нужно провести новое полномасштабное исследование на гораздо большей когорте людей.
Об эксперте: Игорь Решетов — доктор медицинских наук, директор Института кластерной онкологии имени Л.Л. Левшина Сеченовского университета. Академик РАН.
«По всей видимости, у этого препарата действительно имеется универсальный механизм уничтожения вирусов — не только SARS-CoV-2, но и вирусов гриппа и других респираторных патогенов. Но прямо сейчас ни о каком чудодейственном эффекте метиленового синего мы просто не имеем права говорить — пока сделаны лишь первые испытания. Если провести параллель с классическими медицинскими исследованиями, то это лишь первая фаза. Нам очень хочется верить, что мы зафиксировали некий положительный результат и что мы не навредили ни одному из наших пациентов. Собственно, так к этому опыту и надо относиться — и ни в коем случае не говорить, что мы что-то доказали. Вопросов по механизму действия препарата у нас осталось много. Нужно продолжать фундаментальные исследования, а они могут занять и год, и два. Все будет зависеть от финансирования».
Ученые уже подали заявку на грант. Если выиграют, то полученные деньги планируют потратить на организацию совместного исследования с НИИ медицинской приматологии в городе Сочи, где будут дальше изучать воздействие синего красителя на вирусы и иммунную систему на приматах.
Впрочем, российские ученые не единственные, кто поверил в противовирусный потенциал метиленового синего. Исследования, в которых изучается механизм его работы против коронавируса и других респираторных патогенов, сегодня проводятся по всему миру: Иране, Германии, Канаде, США.
Кстати, одно из впечатляющих наблюдений было не так давно сделано во Франции. Там совершенно неожиданно выявили профилактическое противовирусное действие метиленового синего. С момента начала эпидемии COVID-19 в Страсбурге велось наблюдение за 2,5 тыс. французских пациентов, получавших метиленовый синий во время лечения рака. https://riviste.fupress.net/index.php/s ... e/view/888
Несмотря на то, что в семьях некоторых из этих людей наблюдались вспышки короновирусной инфекции, никто из 2,5 тыс. онкобольных так и не заболел.
Редакция РБК Тренды не рекомендует самостоятельно принимать медицинский раствор метиленового синего для лечения или профилактики COVID-19. На сегодняшний день не установлена терапевтическая или профилактическая доза препарата для лечения вирусных инфекций. Также нет точных данных о возможных побочных эффектах. Все исследования на сегодняшний день носят экспериментальный характер.
https://trends.rbc.ru/trends/innovation ... 4cf7f7bb35
Раствор красителя метиленовый синий, известный в народе как «синька», может уничтожать коронавирус в организме человека. К такому выводу пришли российские ученые из Сеченовского университета
В ходе экспериментального лечения пациенты с диагнозом COVID-19 и разной степенью поражения легких полностью выздоровели. В группе добровольцев, принимавших метиленовый синий с целью профилактики, никто не заболел. Значит ли это, что эффективное лекарство от новой болезни наконец найдено?
Долгие месяцы мы наблюдаем за тем, как ВОЗ и представители Big Farma по всему миру ищут эффективное лекарство от COVID-19. Поскольку создание нового препарата — дело не быстрое, а людей по всему миру необходимо лечить, было разрешено применять некоторые медикаменты off-label, то есть не по назначению. И нашумевший гидроксихлорохин, и фавилавир, и многие другие лекарства, которые применялись и применяются для лечения коронавирусной инфекции, создавались для совершенно других болезней. Многие из них трудно купить, а некоторые еще и довольно дорогие.
И вот на фоне непростой ситуации с лечением COVID-19 приходит новость о том, что синий краситель — старое и копеечное медицинское средство (около 8 руб. за дозу), оказывается, может эффективно лечить коронавирусную инфекцию. Вещество убивает сам вирус, восстанавливает многие функции организма и борется с последствиями болезни. Неужели это правда? Научные изыскания на текущий момент (июль 2020 года) говорят — похоже, что так.
Знакомьтесь, метиленовый синий
У пресловутой «синьки» солидное научное реноме. Вещество было синтезировано в 1877 году и изначально применялось в медицине и промышленности как краситель и пигмент. Но позже выяснилось, что метиленовый синий (МС) обладает широким спектром терапевтических свойств.
• С XIX века и по настоящее время МC применяется как противомалярийный препарат. Он одинаково эффективен против всех видов этого паразитарного заболевания.
• МС — одно из первых лекарств, которое успешно применяли для лечения психозов, биполярного и нейродегенеративных расстройств, в том числе деменции и болезни Альцгеймера.
• МС считается эффективным лекарством от метгемоглобинемии — состояния, при котором в крови повышается содержание метгемоглобина (окисленного гемоглобина) и развивается тканевая гипоксия.
• МС входит в список жизненно-важных препаратов по версии Всемирной организации здравоохранения как антидот при отравлении цианидами, угарным газом и сероводородом.
• МС — мощный антиоксидант https://pubmed.ncbi.nlm.nih.gov/28840449/ , который способен блокировать окислительный каскад в организме.
• МС — противовоспалительное средство широкого спектра действия.
• МС обладает и ярким противовирусным эффектом. В 2018 году было доказано https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7169708/ , что метиленовый синий инактивирует в плазме крови вирус Эбола и коронавирус MERS-CoV, вызывающий острый ближневосточный респираторный синдром.
Помимо этого, раствор метиленового синего известен как фотосенсибилизатор. Это группа светочувствительных веществ, действие которых усиливается при воздействии света с соответствующей длиной волны. Фотосенсибилизатор переносит энергию света на кислород, благодаря чему он переходит в так называемое синглетное состояние. Синглетный кислород химически очень активен: он окисляет белки и другие биомолекулы, разрушая внутренние структуры патологических клеток, после чего они становятся нежизнеспособными.
Такое свойство фотосенсибилизаторов позволило успешно применять их в фотодинамической терапии при лечении онкологических заболеваний.
Метиленовый синий против SARS-CoV-2: как родилась идея?
Идея родилась в Институте кластерной онкологии имени Л.Л. Левшина на базе Университетской клинической больницы № 1 Сеченовского университета.
В разгар эпидемии коронавируса, как и многие другие медицинские учреждения в Москве, институт был перепрофилирован под ковидный госпиталь. На тот момент уже существовал список рекомендованных лекарств и протокол лечения одобренный Минздравом России, но сеченовские онкологи все равно задумались о поиске альтернативных методов лечения.
Об эксперте: Артем Ширяев — кандидат медицинских наук, врач-хирург, онколог Института кластерной онкологии имени Л.Л. Левшина Сеченовского университета.
«Поскольку мы совместно с физиками из Института общей физики РАН давно и успешно применяем фотодинамические методы для лечения онкологических больных, то сразу вспомнили об известном фотосенсибилизаторе — метиленовом синем. Он как раз находился у нас в разработке по проекту фотодинамической терапии опухолей мозга. Уже были опубликованы работы российских и зарубежных ученых, подтверждающие способность синего красителя уничтожать некоторые патогенные вирусы в плазме крови при воздействии красного света. И пока мы продумывали, как применить этот опыт к истории с COVID-19, вышла публикация китайских ученых. В статье был описан успешный опыт инактивации вируса SARS-CoV-2 в плазме крови инвитро (то есть в пробирке) с применением светового облучения при различных дозировках метиленового синего. Вирус погибал за считанные минуты при воздействии метиленового синего и за считанные секунды при дополнительном облучении красным светом. Эта работа помогла нам разработать свой протокол лечения. Первыми добровольцами, принявшими метиленовый синий были: я сам, академик РАН и директор Института кластерной онкологии Игорь Решетов, а также профессор Института общей физики РАН Виктор Лощенов. Его лаборатория разрабатывает для нас оборудование для фотодинамической терапии».
По словам хирурга-онколога Ширяева, никакого страха перед приемом метиленового синего не было — препарат давно зарекомендовал свою безопасность. К тому же ученым нужно было точно рассчитать дозу, способную убивать вирус; понять, как это вещество будет выводиться из организма; и спроектировать лазерную установку для проведения фотодинамической терапии.
Об эксперте: Виктор Лощенов — доктор физико-математических наук, профессор Института общей физики им. А.М. Прохорова РАН.
«Когда мы начали эту работу, пандемия была в разгаре. Все в Москве сидели на самоизоляции. Я не мог работать в своей лаборатории, поэтому все подготовительные исследования проводил у себя дома. Я исследовал фармакокинетику метиленового синего на себе и добровольцах и параллельно осуществлял разработку облучателя. В последствии лазерные установки со световой мощностью десятикратно превышающей существующие аналоги, были созданы студентами-выпускникам Института общей физики. Они поставили у себя в общежитии 3D-принтеры, закупили комплектующие и с их помощью «напечатали» четыре облучателя».
После того как и оборудование, и протокол лечения были готовы, ученые подали заявку в независимый локальный комитет по этике Первого Московского государственного медицинского университета имени И.М. Сеченова Минздрава России.
Исследование было утверждено 24 апреля 2020, уже на следующий день экспериментальное лечение метиленовым синим было предложено испытать на себе пациентам с коронавирусной инфекцией. Как ни странно, многие охотно согласились.
Как проходило испытание метиленового синего на больных COVID-19
Исследование проводилось с 25 апреля по 24 мая 2020. В нем приняло участие 43 пациента с подтвержденным диагнозом COVID-19 и 39 добровольцев. В последнюю группу вошли люди с высоким риском заражения — врачи, работавшие в «красной зоне», взрослые члены их семей и ученые, участвовавшие в разработке исследования.
Все добровольцы принимали препарат еженедельно, выпивая индивидуально рассчитанную дозу метиленового синего, разведенного в стакане воды. Фотодинамическая терапия в группе добровольцев не применялась.
Среди 43 пациентов были люди с разной степенью тяжести заболевания и с разной степенью поражения легких: от 25 до 75% по результатам компьютерной томографии. Все они помимо стандартного симптоматического лечения получали метиленовый синий в виде ингаляций и перорально в сочетании с фотодинамической терапией.
С помощью спроектированной светодиодной установки врачи воздействовали красным светом с длиной волны 665 нм на зону носоглотки и груди каждого пациента. При таком воздействии метиленовый синий усиливает свою активность почти в десять раз.
Эффект от лечения наступал быстро. Уже на следующий день у многих пациентов температура спадала с 39°С до 36,6°С. Полностью возвращалось утраченное обоняние. Люди отмечали общее улучшение самочувствия и восстановление функций дыхания. У многих исчезали боли в грудной клетке.
К реанимационным больным возвращалась способность дышать самостоятельно, поднимался уровень сатурации (насыщение крови кислородом). Наблюдалась положительная динамика по КТ — исчезал эффект матового стекла.
После однократного ингаляционного применения метиленового синего с сопутствующей фотодинамической терапией уже на следующий день ПЦР-тест на SARS-CoV-2 у всех пациентов был отрицательным. Вирус был полностью элиминирован из организма.
На 10 и 12 день после госпитализации повторный ПЦР-тест тоже не обнаруживал вирус ни у одного из участников исследования, включая группу добровольцев.
За все время проведения исследования ни у одного из испытуемых не было выявлено никаких побочных эффектов на препарат метиленовый синий.
Как относиться к результатам исследования?
Директор Института кластерной онкологии Сеченовского университета и академик РАН Игорь Решетов считает, что потенциал у метиленового синего любопытный. Возможно, он будет иметь свою точку приложения в лечении острых респираторных инфекций, например, на старте болезни. Но прежде, чем уверенно говорить о каких-то противовирусных эффектах препарата, нужно провести новое полномасштабное исследование на гораздо большей когорте людей.
Об эксперте: Игорь Решетов — доктор медицинских наук, директор Института кластерной онкологии имени Л.Л. Левшина Сеченовского университета. Академик РАН.
«По всей видимости, у этого препарата действительно имеется универсальный механизм уничтожения вирусов — не только SARS-CoV-2, но и вирусов гриппа и других респираторных патогенов. Но прямо сейчас ни о каком чудодейственном эффекте метиленового синего мы просто не имеем права говорить — пока сделаны лишь первые испытания. Если провести параллель с классическими медицинскими исследованиями, то это лишь первая фаза. Нам очень хочется верить, что мы зафиксировали некий положительный результат и что мы не навредили ни одному из наших пациентов. Собственно, так к этому опыту и надо относиться — и ни в коем случае не говорить, что мы что-то доказали. Вопросов по механизму действия препарата у нас осталось много. Нужно продолжать фундаментальные исследования, а они могут занять и год, и два. Все будет зависеть от финансирования».
Ученые уже подали заявку на грант. Если выиграют, то полученные деньги планируют потратить на организацию совместного исследования с НИИ медицинской приматологии в городе Сочи, где будут дальше изучать воздействие синего красителя на вирусы и иммунную систему на приматах.
Впрочем, российские ученые не единственные, кто поверил в противовирусный потенциал метиленового синего. Исследования, в которых изучается механизм его работы против коронавируса и других респираторных патогенов, сегодня проводятся по всему миру: Иране, Германии, Канаде, США.
Кстати, одно из впечатляющих наблюдений было не так давно сделано во Франции. Там совершенно неожиданно выявили профилактическое противовирусное действие метиленового синего. С момента начала эпидемии COVID-19 в Страсбурге велось наблюдение за 2,5 тыс. французских пациентов, получавших метиленовый синий во время лечения рака. https://riviste.fupress.net/index.php/s ... e/view/888
Несмотря на то, что в семьях некоторых из этих людей наблюдались вспышки короновирусной инфекции, никто из 2,5 тыс. онкобольных так и не заболел.
Редакция РБК Тренды не рекомендует самостоятельно принимать медицинский раствор метиленового синего для лечения или профилактики COVID-19. На сегодняшний день не установлена терапевтическая или профилактическая доза препарата для лечения вирусных инфекций. Также нет точных данных о возможных побочных эффектах. Все исследования на сегодняшний день носят экспериментальный характер.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.mk.ru/social/2020/07/01/lec ... ibina.html
Лечение коронавируса синькой выявило "синдром Кулибина"
Медицинское сообщество оценивает открытие с большим скепсисом
Российские ученые потрясли мир неординарным открытием. Оказывается, коронавирус нового типа может поддаться лечению элементарным средством, которое стоит от 8 рублей за дозу. И это средство есть у многих домохозяйки страны. Ибо это водный раствор красителя метиленовый синий, который в обыденной речи иногда именуют синькой. Его можно купить в любой аптеке и использовать в том числе для стирки белья и для чистки аквариумов.
Исследования, которые провели на пяти десятках COVID-положительных добровольцах ученые Института общей физики имени А. М. Прохорова РАН (ИОФ РАН), показали, что вирус сдался под напором красителя: симптомы исчезли уже на следующий день и пациенты выздоровели. И все же врачи оценили результаты открытия с большой долей скепсиса.
Ученые ИОФ РАН не сомневаются в том, что краситель метиленовый синий может достаточно быстро уничтожить в организме коронавирус нового типа. Данные своего исследования они уже отправили в научный журнал Nature Medicine.
Как пояснили исследователи, раствор метиленового синего не впервые применяется в медицинской практике: его пользуют для лечения пациентов, получивших отравление угарным газом, а также при инфекциях мочеполовой системы, септическом шоке, малярии. Поэтому протестировать синьку на пациентах с новым коронавирусом решили не просто так.
Для усиления эффекта добровольцам проводили облучение красным светом (фотодинамическую терапию области носа, глотки или легких). Состояние пациентов в группе испытуемых варьировалось от легкого до тяжелого. Препарат применялся либо внутрь (в виде водного раствора), либо ингаляционно. При этом, отмечают авторы клинического исследования, все добровольцы быстро вылечились. Например, уже на следующее утро после терапии у них восстановилось обоняние, самочувствие улучшилось, а тесты ни у кого не показали наличия вируса в крови. У людей с тяжелым течением был остановлен процесс разрушения легочной ткани.
Исследователи считают, что синька способна гасить цитокиновый шторм – реакцию иммунной системы, которая разрушает ткани организма и часто приводит к смерти пациента. И все же подчеркивается, что независимые эксперты не проверяли достоверность результатов исследования, поэтому его выводы могут оказаться не точными и нуждаются в дополнительных подтверждениях.
"МК" попросил прокомментировать данные исследования известного специалиста по токсикологии и фармакологии, патологоанатома Александра Эдигера.
- У нас есть эксперты, которые предлагают пациентам дышать парами этанола и горячим гелием, так что я не удивлен, - начал Александр Владимирович. – Теперь вот мешают синьку с красным облучением. На самом деле ситуация вполне ожидаемая.
Несмотря на то, что в стране уже появились блестящие схемы терапии пациентов с коронавирусом нового типа, разработанные Клиническим центром МГУ, клинически обоснованные, подробно и детально расписывающие все направления, есть пытливые немедицинские коллективы, которые не могут смириться с тем, что кто-то из врачей что-то придумал. И вот они начинают развлекаться на свой манер. Больше всего развлекается Всемирная Организация Здравоохранения (ВОЗ), которая дексаметазон при COVID объявила научным прорывом. Если бы кто-то из студентов на втором курсе мне такое сказал, он летел бы с двумя баллами на переэкзаменовку. А ВОЗ послать на переэкзаменовку некому, разве что денег их лишить (в чем мы трогательно совпадаем с Дональдом Трампом).
- А что все-таки с лечением метиленовым синим?
- Это, конечно, может оказаться крайне интересно. Но было бы гораздо интереснее и впечатляло бы больше, если бы кто-то провел реальное клиническое исследование полного формата, а не наблюдение за несколькими десятками пациентов, и описал – в крайнем случае, предположил бы - механизмы действия. Фотодинамическая терапия - это крайне модно, а метиленовая синь, которая в медицине используется с конца XIX века, уже давно не модна.
Конечно, тестировать для лечения нового коронавируса сегодня можно многое, но методы должны быть обоснованными и подтвержденными на большом количестве пациентов. А вообще то, что происходит сегодня, это проявление синдрома Кулибина – создание из подручных материалов неких интересных игрушек. Этот синдром не только российский, сейчас он стал всемирным. И это за последние полгода, мои извинения, все это немножко надоело.
Лечение коронавируса синькой выявило "синдром Кулибина"
Медицинское сообщество оценивает открытие с большим скепсисом
Российские ученые потрясли мир неординарным открытием. Оказывается, коронавирус нового типа может поддаться лечению элементарным средством, которое стоит от 8 рублей за дозу. И это средство есть у многих домохозяйки страны. Ибо это водный раствор красителя метиленовый синий, который в обыденной речи иногда именуют синькой. Его можно купить в любой аптеке и использовать в том числе для стирки белья и для чистки аквариумов.
Исследования, которые провели на пяти десятках COVID-положительных добровольцах ученые Института общей физики имени А. М. Прохорова РАН (ИОФ РАН), показали, что вирус сдался под напором красителя: симптомы исчезли уже на следующий день и пациенты выздоровели. И все же врачи оценили результаты открытия с большой долей скепсиса.
Ученые ИОФ РАН не сомневаются в том, что краситель метиленовый синий может достаточно быстро уничтожить в организме коронавирус нового типа. Данные своего исследования они уже отправили в научный журнал Nature Medicine.
Как пояснили исследователи, раствор метиленового синего не впервые применяется в медицинской практике: его пользуют для лечения пациентов, получивших отравление угарным газом, а также при инфекциях мочеполовой системы, септическом шоке, малярии. Поэтому протестировать синьку на пациентах с новым коронавирусом решили не просто так.
Для усиления эффекта добровольцам проводили облучение красным светом (фотодинамическую терапию области носа, глотки или легких). Состояние пациентов в группе испытуемых варьировалось от легкого до тяжелого. Препарат применялся либо внутрь (в виде водного раствора), либо ингаляционно. При этом, отмечают авторы клинического исследования, все добровольцы быстро вылечились. Например, уже на следующее утро после терапии у них восстановилось обоняние, самочувствие улучшилось, а тесты ни у кого не показали наличия вируса в крови. У людей с тяжелым течением был остановлен процесс разрушения легочной ткани.
Исследователи считают, что синька способна гасить цитокиновый шторм – реакцию иммунной системы, которая разрушает ткани организма и часто приводит к смерти пациента. И все же подчеркивается, что независимые эксперты не проверяли достоверность результатов исследования, поэтому его выводы могут оказаться не точными и нуждаются в дополнительных подтверждениях.
"МК" попросил прокомментировать данные исследования известного специалиста по токсикологии и фармакологии, патологоанатома Александра Эдигера.
- У нас есть эксперты, которые предлагают пациентам дышать парами этанола и горячим гелием, так что я не удивлен, - начал Александр Владимирович. – Теперь вот мешают синьку с красным облучением. На самом деле ситуация вполне ожидаемая.
Несмотря на то, что в стране уже появились блестящие схемы терапии пациентов с коронавирусом нового типа, разработанные Клиническим центром МГУ, клинически обоснованные, подробно и детально расписывающие все направления, есть пытливые немедицинские коллективы, которые не могут смириться с тем, что кто-то из врачей что-то придумал. И вот они начинают развлекаться на свой манер. Больше всего развлекается Всемирная Организация Здравоохранения (ВОЗ), которая дексаметазон при COVID объявила научным прорывом. Если бы кто-то из студентов на втором курсе мне такое сказал, он летел бы с двумя баллами на переэкзаменовку. А ВОЗ послать на переэкзаменовку некому, разве что денег их лишить (в чем мы трогательно совпадаем с Дональдом Трампом).
- А что все-таки с лечением метиленовым синим?
- Это, конечно, может оказаться крайне интересно. Но было бы гораздо интереснее и впечатляло бы больше, если бы кто-то провел реальное клиническое исследование полного формата, а не наблюдение за несколькими десятками пациентов, и описал – в крайнем случае, предположил бы - механизмы действия. Фотодинамическая терапия - это крайне модно, а метиленовая синь, которая в медицине используется с конца XIX века, уже давно не модна.
Конечно, тестировать для лечения нового коронавируса сегодня можно многое, но методы должны быть обоснованными и подтвержденными на большом количестве пациентов. А вообще то, что происходит сегодня, это проявление синдрома Кулибина – создание из подручных материалов неких интересных игрушек. Этот синдром не только российский, сейчас он стал всемирным. И это за последние полгода, мои извинения, все это немножко надоело.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7440159/
Application of methylene blue -vitamin C -N-acetyl cysteine for treatment of critically ill COVID-19 patients, report of a phase-I clinical trial
Применение метиленового синего, витамина C и N-ацетилцистеина для лечения тяжелобольных пациентов с COVID-19, отчет о клиническом исследовании фазы I
(август 2020)
Абстракт
COVID-19 - глобальное катастрофическое событие, вызывающее тяжелый острый респираторный синдром. Механизм заболевания остается неясным, а гипоксия - одно из основных осложнений. В настоящее время нет утвержденного протокола лечения. Микробная угроза, вызванная COVID-19, вызывает активацию макрофагов с образованием огромного количества воспалительных молекул и оксида азота (NO). Активация популяции макрофагов в провоспалительный фенотип вызывает цикл самоусиливания. Окислительный стресс и NO вносят свой вклад в этот цикл, создавая каскадное воспалительное состояние, которое может убить пациента. Прерывание этого порочного круга простым средством может спасти жизни критически важных пациентов. Уровни нитритов, нитратов (метаболитов NO), метгемоглобина и прооксидантно-антиоксидантного баланса были измерены у 25 пациентов ICU COVID-19 и 25 здоровых людей. В качестве последнего варианта лечения пяти пациентам вводили метиленовый синий + витамин C + N-ацетилцистеин (MCN). Нитриты, нитраты, метгемоглобин и окислительный стресс были значительно выше у пациентов по сравнению со здоровыми людьми. Четыре из пяти пациентов хорошо ответили на лечение. В заключение, NO, метгемоглобин и окислительный стресс могут играть центральную роль в патогенезе критического заболевания COVID-19. Лечение MCN, по-видимому, увеличивает выживаемость этих пациентов. Принимая во внимание порочный круг активации макрофагов, ведущий к смертельному исходу NO, окислительному стрессу и синдрому цитокинового каскада; терапевтический эффект MCN кажется разумным. Соответственно, было разработано более широкое клиническое исследование. Следует отметить, что в протоколе используются недорогие препараты, одобренные FDA для лечения других заболеваний.
В этом исследовании нитрит, нитрат (метаболиты NO), метгемоглобин (met-Hb) и прооксидантно-антиоксидантный баланс (PAB) были оценены как факторы, влияющие на усиление гипоксии у пациентов в отделении интенсивной терапии. Пятерым пациентам с COVID 19 в критическом состоянии после стандартных процедур, которые врачи охарактеризовали как завершающие, были введены MС, витамин C и N-ацетилцистеин в качестве сострадательной терапии, и они были включены в более крупное клиническое исследование, которое уже работает.
В качестве последнего терапевтического варианта пять из 25 пациентов ICU COVID-19 были набраны для клинических испытаний и лечения MCN. Пациентам вводили MС (1 мг / кг) вместе с витамином C (1500 мг / кг) и N-ацетилцистеином (1500 мг / кг) перорально или внутривенно, как описано для каждого случая.
Предварительные результаты этого клинического исследования показали, что лечение тяжелой формы COVID-19 смесью MС, витамина C и N-ацетилцистеина является безопасным и возможным. Уменьшение МС имеет быстрые и отсроченные эффекты. Быстрый эффект увеличивает SPO2% (все пациенты получали 100% кислород) за счет снижения met-Hb. Отсроченные эффекты обусловлены ускорением обычно медленной НАДФН-метгемоглобинредуктазы, улучшением воспалительных маркеров, таких как уровень СРБ и ЛДГ, снижением тяжести заболевания, что также может быть связано с антимикробным действием. Мы предлагаем оптимальное время для введения редуцированного метиленового синего (LMB) до того, как пациент попадет в очень тяжелую стадию заболевания, вовлечение и отказ нескольких органов. По мнению авторов, наблюдаемые результаты, если они будут подтверждены на большем количестве пациентов и рандомизированном многоцентровом клиническом исследовании, могут значительно снизить смертность от инфекции COVID-19 и среднюю продолжительность пребывания в ОИТ.
Application of methylene blue -vitamin C -N-acetyl cysteine for treatment of critically ill COVID-19 patients, report of a phase-I clinical trial
Применение метиленового синего, витамина C и N-ацетилцистеина для лечения тяжелобольных пациентов с COVID-19, отчет о клиническом исследовании фазы I
(август 2020)
Абстракт
COVID-19 - глобальное катастрофическое событие, вызывающее тяжелый острый респираторный синдром. Механизм заболевания остается неясным, а гипоксия - одно из основных осложнений. В настоящее время нет утвержденного протокола лечения. Микробная угроза, вызванная COVID-19, вызывает активацию макрофагов с образованием огромного количества воспалительных молекул и оксида азота (NO). Активация популяции макрофагов в провоспалительный фенотип вызывает цикл самоусиливания. Окислительный стресс и NO вносят свой вклад в этот цикл, создавая каскадное воспалительное состояние, которое может убить пациента. Прерывание этого порочного круга простым средством может спасти жизни критически важных пациентов. Уровни нитритов, нитратов (метаболитов NO), метгемоглобина и прооксидантно-антиоксидантного баланса были измерены у 25 пациентов ICU COVID-19 и 25 здоровых людей. В качестве последнего варианта лечения пяти пациентам вводили метиленовый синий + витамин C + N-ацетилцистеин (MCN). Нитриты, нитраты, метгемоглобин и окислительный стресс были значительно выше у пациентов по сравнению со здоровыми людьми. Четыре из пяти пациентов хорошо ответили на лечение. В заключение, NO, метгемоглобин и окислительный стресс могут играть центральную роль в патогенезе критического заболевания COVID-19. Лечение MCN, по-видимому, увеличивает выживаемость этих пациентов. Принимая во внимание порочный круг активации макрофагов, ведущий к смертельному исходу NO, окислительному стрессу и синдрому цитокинового каскада; терапевтический эффект MCN кажется разумным. Соответственно, было разработано более широкое клиническое исследование. Следует отметить, что в протоколе используются недорогие препараты, одобренные FDA для лечения других заболеваний.
В этом исследовании нитрит, нитрат (метаболиты NO), метгемоглобин (met-Hb) и прооксидантно-антиоксидантный баланс (PAB) были оценены как факторы, влияющие на усиление гипоксии у пациентов в отделении интенсивной терапии. Пятерым пациентам с COVID 19 в критическом состоянии после стандартных процедур, которые врачи охарактеризовали как завершающие, были введены MС, витамин C и N-ацетилцистеин в качестве сострадательной терапии, и они были включены в более крупное клиническое исследование, которое уже работает.
В качестве последнего терапевтического варианта пять из 25 пациентов ICU COVID-19 были набраны для клинических испытаний и лечения MCN. Пациентам вводили MС (1 мг / кг) вместе с витамином C (1500 мг / кг) и N-ацетилцистеином (1500 мг / кг) перорально или внутривенно, как описано для каждого случая.
Предварительные результаты этого клинического исследования показали, что лечение тяжелой формы COVID-19 смесью MС, витамина C и N-ацетилцистеина является безопасным и возможным. Уменьшение МС имеет быстрые и отсроченные эффекты. Быстрый эффект увеличивает SPO2% (все пациенты получали 100% кислород) за счет снижения met-Hb. Отсроченные эффекты обусловлены ускорением обычно медленной НАДФН-метгемоглобинредуктазы, улучшением воспалительных маркеров, таких как уровень СРБ и ЛДГ, снижением тяжести заболевания, что также может быть связано с антимикробным действием. Мы предлагаем оптимальное время для введения редуцированного метиленового синего (LMB) до того, как пациент попадет в очень тяжелую стадию заболевания, вовлечение и отказ нескольких органов. По мнению авторов, наблюдаемые результаты, если они будут подтверждены на большем количестве пациентов и рандомизированном многоцентровом клиническом исследовании, могут значительно снизить смертность от инфекции COVID-19 и среднюю продолжительность пребывания в ОИТ.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7409924/
Methylene blue may have a role in the treatment of COVID-19
(август 2020)
Метиленовый синий может играть роль в лечении COVID-19
Абстракт
В этой статье мы выдвигаем гипотезу о том, что метиленовый синий может быть вариантом лечения коронавирусной болезни 2019 года, особенно в сочетании с нестероидными противовоспалительными препаратами. В предыдущих публикациях, в том числе и в нашей, постулировалась роль кининогенной системы. Была проведена корреляция между клиническими проявлениями заболевания и этим механизмом, чтобы обозначить ключевую роль кининоген-калликреиновой системы в патофизиологии заболевания. В связи с этим была поднята возможная роль икатибанта, экаллантида и апротинина в лечении этого заболевания. Здесь мы хотим подчеркнуть важный пострецепторный механизм брадикинина, которым является оксид азота. Мы пришли к этой цели, потому что узнали, как доступ к этим новым кандидатам на лечение может быть дорогим и недоступным. По этой причине мы сосредотачиваемся на возможной роли старого, хотя и «загадочного» препарата, а именно метиленового синего. Это лекарство может прервать действие брадикинина путем ингибирования ингибитора синтазы оксида азота и способствовать насыщению кислородом, в то время как оно недорого и повсеместно доступно.
Methylene blue may have a role in the treatment of COVID-19
(август 2020)
Метиленовый синий может играть роль в лечении COVID-19
Абстракт
В этой статье мы выдвигаем гипотезу о том, что метиленовый синий может быть вариантом лечения коронавирусной болезни 2019 года, особенно в сочетании с нестероидными противовоспалительными препаратами. В предыдущих публикациях, в том числе и в нашей, постулировалась роль кининогенной системы. Была проведена корреляция между клиническими проявлениями заболевания и этим механизмом, чтобы обозначить ключевую роль кининоген-калликреиновой системы в патофизиологии заболевания. В связи с этим была поднята возможная роль икатибанта, экаллантида и апротинина в лечении этого заболевания. Здесь мы хотим подчеркнуть важный пострецепторный механизм брадикинина, которым является оксид азота. Мы пришли к этой цели, потому что узнали, как доступ к этим новым кандидатам на лечение может быть дорогим и недоступным. По этой причине мы сосредотачиваемся на возможной роли старого, хотя и «загадочного» препарата, а именно метиленового синего. Это лекарство может прервать действие брадикинина путем ингибирования ингибитора синтазы оксида азота и способствовать насыщению кислородом, в то время как оно недорого и повсеместно доступно.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://medium.com/@dr.deepak.golwalkar ... 3fc5a31a4d
Treatment for COVID-19 using Methylene Blue
(апрель 2020)
Использование метиленового синего в небулайзерной форме для лечения пациентов с коронавирусом (Covid-19)
Поскольку COVID-19 (коронавирус) разрушает мир, необходимо найти быстрое, новое и экономичное лекарство от этого недуга.
Будучи пульмонологом (специалистом по легким) в Индии, я лечил пневмонию, другие респираторные заболевания и пациентов с туберкулезом (с ШЛУ и МЛУ ТБ) более 42 лет.
Я добился замечательных успехов в лечении своих пациентов метиленовым синим и получил документальные подтверждения. При использовании в сублингвальной и небулайзерной формах MС заметно помогает в устранении блока альвеолярных капилляров.
Covid вызывает «тихую» гипоксию, при которой пациенты, несмотря на острую гипоксию (низкое насыщение кислородом spO2), не проявляют клинических симптомов. У пациента отсутствует одышка, несмотря на очень низкую сатурацию кислорода. Они вскоре перерастают в цитокиновый шторм, и у пациента наступает необратимая фаза респираторного дистресса.
Пациенты с Covid обнаруживают сходство с метгемоглобинемией. МС считается одобренным препаратом выбора при метгемоглобинемии. Кроме того, МС обладает сильным антифибротическим действием и очень быстро действует.
Учитывая приведенные выше презентации, метиленовый синий можно использовать в качестве лечения для всех пациентов с симптомами коронавируса и в качестве профилактического препарата для всего уязвимого населения. При использовании в низкой дозировке (как указано ниже) он не вызывает значительных побочных эффектов (менее 2% пациентов жаловались на раздражение в носу/тошноту в течение дня, которая исчезла сама по себе). Учитывая его низкую стоимость, это также жизнеспособный режим для более бедных стран, таких как Индия. Ряд пациентов (с различными уровнями респираторного дистресс-синдрома) лечились с помощью MС в небулайзере / сублингвальном режиме в течение многих лет моей практики.
Возможный режим лечения нового коронавируса (Covid-19)
Первичный курс приема - в небулайзированной форме и сублингвально вместе. Пациентам с тяжелым цианозом (уровень кислорода менее 85%) может потребоваться внутривенное введение в зависимости от клинического состояния пациента.
Шаги введения, указанные ниже (только под наблюдением врача, поскольку известно, что МС токсичен в неправильных дозировках)
• 0,1% метиленовый синий для ингаляционного введения через небулайзер (основная линия лечения)
• Распыление через носовую маску
• Сублингвальное введение будет в качестве поддерживающей линии лечения.
После моих рекомендаций больница в Мумбаи начала вводить метиленовый синий через небулайзер, а также сублингвально пациентам с подтвержденным COVID-19 с положительными результатами.
Метиленовый синий (хлорид метилтиониния) - это тиазиновый краситель и лекарство. Его легко купить в аптеках по всей Индии. Безопасно употреблять в низких дозах (0,1 мг/кг в виде внутривенного введения) под надлежащим медицинским наблюдением. Это был первый антисептический краситель, который использовался в терапевтических целях, и он присутствует в Примерном перечне основных лекарственных средств ВОЗ. Фактически, его использование было широко распространено еще до появления сульфаниламидов и пенициллина. Его преимущество в том, что он быстро останавливает фиброз, что оказывается полезным против вирулентных штаммов.
[Обновление: почему работает МС]
Есть несколько причин, по которым MС эффективен; главным является опосредованное оксидом азота уменьшение воспалительных каскадов в дополнение к ингибированию канонических инфламмасом.
Рентгенологически (например, на рентгеновском снимке) Covid/свиной грипп похожи и напоминают любые острые вирусные / грибковые заболевания или аспирационную пневмонию. Клиническое различие можно сделать, введя интраназальный кислород - вы заметите улучшение при нормальной пневмонии, но не при свином гриппе или Covid-19, поскольку эти вирусы могут привести к закупорке альвеолярных капилляров (то есть блокировать способность легких работать простыми словами) . МС очищает закупорку в течение 24 часов, и уровень O2 начинает улучшаться. Covid-19 является более вирулентным штаммом по сравнению с H1N1, поэтому для него необходимы препараты быстрого действия.
Из-за клинического / патологического сходства между H1N1 и Covid-19 ожидается, что конечный результат будет аналогичным после введения MС.
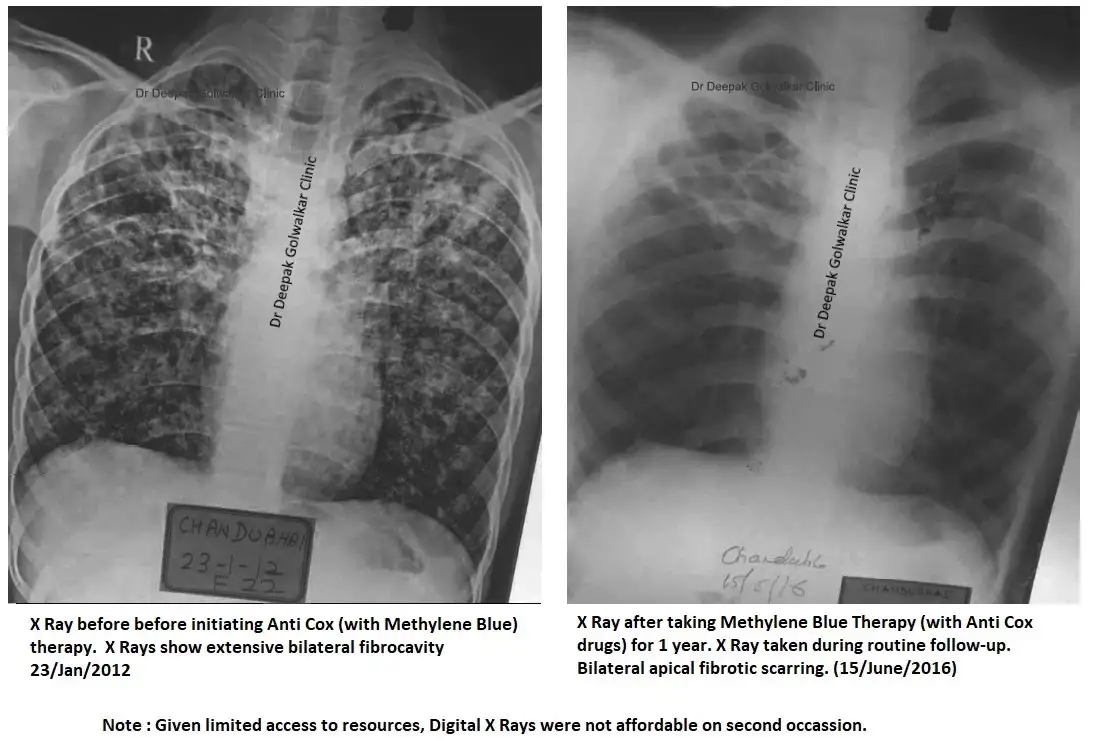
Примечание: некоторые читатели задавались вопросом, почему для устранения поражений потребовалось 4 года — учитывая состояние пациента, когда он пришел ко мне, шансы на выживание более 6 месяцев были менее 10%, так как его легкое было сильно повреждено (рентгеновский снимок 1). На медицинском языке вышеупомянутый прогресс X Ray (рентгеновский снимок 2) считается чудом.
(Я опубликую более подробную информацию об этом, как и когда у меня будет время — для запросов, пожалуйста, напишите мне)
С подробной схемой лечения можно ознакомиться здесь: https://bit.ly/3kOxOyS
Изменение 1
Примечание:
Мы по-прежнему наблюдаем очень хорошие результаты при распылении метиленового синего/сублингвальном введении. Учитывая положительные результаты, которые мы наблюдаем, мы твердо верим, что метиленовый синий является наиболее экономичным средством выбора в эти трудные времена.
Мы получили жалобы на то, что некоторые организации/люди используют имя доктора Голвалкарса для дискредитации метиленового синего в своих интересах. Обратите внимание, что мы по-прежнему наблюдаем очень хорошие результаты с метиленовым синим и продолжаем рекомендовать его применение.
Подробную схему лечения можно найти, нажав здесь: https://methylene-blue.conzapp.com/meth ... rophylaxis
Treatment for COVID-19 using Methylene Blue
(апрель 2020)
Использование метиленового синего в небулайзерной форме для лечения пациентов с коронавирусом (Covid-19)
Поскольку COVID-19 (коронавирус) разрушает мир, необходимо найти быстрое, новое и экономичное лекарство от этого недуга.
Будучи пульмонологом (специалистом по легким) в Индии, я лечил пневмонию, другие респираторные заболевания и пациентов с туберкулезом (с ШЛУ и МЛУ ТБ) более 42 лет.
Я добился замечательных успехов в лечении своих пациентов метиленовым синим и получил документальные подтверждения. При использовании в сублингвальной и небулайзерной формах MС заметно помогает в устранении блока альвеолярных капилляров.
Covid вызывает «тихую» гипоксию, при которой пациенты, несмотря на острую гипоксию (низкое насыщение кислородом spO2), не проявляют клинических симптомов. У пациента отсутствует одышка, несмотря на очень низкую сатурацию кислорода. Они вскоре перерастают в цитокиновый шторм, и у пациента наступает необратимая фаза респираторного дистресса.
Пациенты с Covid обнаруживают сходство с метгемоглобинемией. МС считается одобренным препаратом выбора при метгемоглобинемии. Кроме того, МС обладает сильным антифибротическим действием и очень быстро действует.
Учитывая приведенные выше презентации, метиленовый синий можно использовать в качестве лечения для всех пациентов с симптомами коронавируса и в качестве профилактического препарата для всего уязвимого населения. При использовании в низкой дозировке (как указано ниже) он не вызывает значительных побочных эффектов (менее 2% пациентов жаловались на раздражение в носу/тошноту в течение дня, которая исчезла сама по себе). Учитывая его низкую стоимость, это также жизнеспособный режим для более бедных стран, таких как Индия. Ряд пациентов (с различными уровнями респираторного дистресс-синдрома) лечились с помощью MС в небулайзере / сублингвальном режиме в течение многих лет моей практики.
Возможный режим лечения нового коронавируса (Covid-19)
Первичный курс приема - в небулайзированной форме и сублингвально вместе. Пациентам с тяжелым цианозом (уровень кислорода менее 85%) может потребоваться внутривенное введение в зависимости от клинического состояния пациента.
Шаги введения, указанные ниже (только под наблюдением врача, поскольку известно, что МС токсичен в неправильных дозировках)
• 0,1% метиленовый синий для ингаляционного введения через небулайзер (основная линия лечения)
• Распыление через носовую маску
• Сублингвальное введение будет в качестве поддерживающей линии лечения.
После моих рекомендаций больница в Мумбаи начала вводить метиленовый синий через небулайзер, а также сублингвально пациентам с подтвержденным COVID-19 с положительными результатами.
Метиленовый синий (хлорид метилтиониния) - это тиазиновый краситель и лекарство. Его легко купить в аптеках по всей Индии. Безопасно употреблять в низких дозах (0,1 мг/кг в виде внутривенного введения) под надлежащим медицинским наблюдением. Это был первый антисептический краситель, который использовался в терапевтических целях, и он присутствует в Примерном перечне основных лекарственных средств ВОЗ. Фактически, его использование было широко распространено еще до появления сульфаниламидов и пенициллина. Его преимущество в том, что он быстро останавливает фиброз, что оказывается полезным против вирулентных штаммов.
[Обновление: почему работает МС]
Есть несколько причин, по которым MС эффективен; главным является опосредованное оксидом азота уменьшение воспалительных каскадов в дополнение к ингибированию канонических инфламмасом.
Рентгенологически (например, на рентгеновском снимке) Covid/свиной грипп похожи и напоминают любые острые вирусные / грибковые заболевания или аспирационную пневмонию. Клиническое различие можно сделать, введя интраназальный кислород - вы заметите улучшение при нормальной пневмонии, но не при свином гриппе или Covid-19, поскольку эти вирусы могут привести к закупорке альвеолярных капилляров (то есть блокировать способность легких работать простыми словами) . МС очищает закупорку в течение 24 часов, и уровень O2 начинает улучшаться. Covid-19 является более вирулентным штаммом по сравнению с H1N1, поэтому для него необходимы препараты быстрого действия.
Из-за клинического / патологического сходства между H1N1 и Covid-19 ожидается, что конечный результат будет аналогичным после введения MС.
(Вышеупомянутые сравнительные рентгеновские снимки являются частью серии. X-Rays поделились согласием пациента на публикацию)
Примечание: некоторые читатели задавались вопросом, почему для устранения поражений потребовалось 4 года — учитывая состояние пациента, когда он пришел ко мне, шансы на выживание более 6 месяцев были менее 10%, так как его легкое было сильно повреждено (рентгеновский снимок 1). На медицинском языке вышеупомянутый прогресс X Ray (рентгеновский снимок 2) считается чудом.
(Я опубликую более подробную информацию об этом, как и когда у меня будет время — для запросов, пожалуйста, напишите мне)
С подробной схемой лечения можно ознакомиться здесь: https://bit.ly/3kOxOyS
Изменение 1
Примечание:
Мы по-прежнему наблюдаем очень хорошие результаты при распылении метиленового синего/сублингвальном введении. Учитывая положительные результаты, которые мы наблюдаем, мы твердо верим, что метиленовый синий является наиболее экономичным средством выбора в эти трудные времена.
Мы получили жалобы на то, что некоторые организации/люди используют имя доктора Голвалкарса для дискредитации метиленового синего в своих интересах. Обратите внимание, что мы по-прежнему наблюдаем очень хорошие результаты с метиленовым синим и продолжаем рекомендовать его применение.
Подробную схему лечения можно найти, нажав здесь: https://methylene-blue.conzapp.com/meth ... rophylaxis
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
From Mitochondrial Function to Neuroprotection – An Emerging Role for Methylene Blue
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5826781/
(июнь 2018)
От митохондриальной функции к нейропротекции — новая роль метиленового синего
Абстракт
Метиленовый синий (МС) является хорошо зарекомендовавшим себя препаратом с долгой историей использования благодаря широкому спектру применения и минимальному профилю побочных эффектов. MС классически использовался для лечения малярии, метгемоглобинемии и отравления угарным газом, а также в качестве гистологического красителя.
Однако в последние годы его роль в митохондриях вызвала новый интерес. МС может перенаправлять электроны в митохондриальной цепи переноса электронов непосредственно с НАДН на цитохром с, повышая активность комплекса IV и эффективно стимулируя активность митохондрий при одновременном смягчении окислительного стресса. В дополнение к его благотворному влиянию на митохондриальную защиту, также известно, что MС оказывает сильное влияние на смягчение нейровоспаления. Митохондриальная дисфункция была идентифицирована как объединяющее патологическое явление для широкого спектра нейродегенеративных расстройств, что, таким образом, делает метиленовый синий перспективным терапевтическим средством.
В исследованиях как in vitro, так и in vivo MС продемонстрировал впечатляющую эффективность в смягчении нейродегенерации и сопутствующих поведенческих фенотипов на животных моделях при таких состояниях, как инсульт, глобальная церебральная ишемия, болезнь Альцгеймера, болезнь Паркинсона и черепно-мозговая травма.
В этом обзоре обобщается недавняя работа, устанавливающая, что MС является многообещающим кандидатом для нейропротекции, с особым акцентом на вклад митохондриальной функции в здоровье нервной системы.
Кроме того, в этом обзоре будет кратко рассмотрена связь между MС, нейрогенезом и улучшением когнитивных функций в отношении возрастного снижения когнитивных функций.
1. Введение
В современной фармакологии большое внимание уделяется перепрофилированию лекарств, использованию ранее одобренных лекарств в новых условиях. Перепрофилирование уже существующих лекарств экономит время и деньги и может привести к клиническому применению гораздо быстрее, чем новое терапевтическое средство, благодаря установленному опыту обширных испытаний на безопасность. Эта стратегия обязательна в областях исследований с высоким риском, таких как нейродегенеративные заболевания, где фармацевтические компании могут неохотно инвестировать большие суммы денег из-за разочаровывающего опыта клинических испытаний высокого уровня. Такие состояния, как инсульт, болезнь Альцгеймера (БА) и болезнь Паркинсона (БП), являются разрушительными и сопровождаются пожизненными последствиями, в результате чего у пациентов и их семей снижается продолжительность и качество жизни. Это влияние усугубляется отсутствием медицинских возможностей, которые могут замедлить или обратить вспять прогрессирование заболевания. Эти состояния остро нуждаются в новых методах лечения и потенциально могут значительно выиграть от финансовой и клинической привлекательности нового применения проверенного временем лекарства.
Метиленовый синий (МС) является одним из таких примеров многообещающего препарата с потенциалом для повторного использования. Впервые синтезированный в 1876 году в качестве красителя для текстиля, MС исследовали на предмет его медицинского применения еще в 1891 году [1]. МБ классически использовался в клинике в качестве сильнодействующего противомалярийного средства, средства для лечения метгемоглобинемии и в качестве медицинского окрашивающего средства [2]. Доказательства также показали, что MС эффективен в качестве профилактической терапии вазоплегического синдрома, возникающего после операции аортокоронарного шунтирования и септического шока в результате вазомодулирующего действия MС, которое основано на его ингибировании гуанилатциклазы (GC) и синтазы оксида азота. [3].
Хотя этиология и прогрессирование основных нейродегенеративных заболеваний сильно различаются, общим для всех является митохондриальная дисфункция. При нейродегенеративных состояниях, таких как инсульт, БА, БП или черепно-мозговая травма (ЧМТ), митохондриальная дисфункция и окислительный стресс являются ключом к прогрессирующему изнурительному характеру состояния [4]. Нарушение митохондриальной цепи переноса электронов из-за прямого повреждения или недостаточного оборота приводит к дефициту энергии и высвобождению активных форм кислорода, которые могут вызывать прямое и последующее повреждение и вредные эффекты [5]. Таким образом, нацеливание и улучшение здоровья митохондрий является главной целью новых методов лечения. Митохондриальный механизм MС, а также его установленные показатели безопасности делают его кандидатом на лечение этих разрушительных состояний.
В этом обзоре будут обсуждаться основные механизмы митохондриальной дисфункции при каждом из основных нейродегенеративных заболеваний, а также будут оцениваться недавние исследования, изучающие влияние MС на каждое из них. Будут выделены исследования, в которых основное внимание уделяется растущей роли MС как рециркулирующего антиоксиданта и альтернативного переносчика электронов в митохондриальной цепи переноса электронов в контексте нейродегенерации [5]. Когда это возможно, комбинированная терапия будет сравниваться с монотерапией. Мы также кратко рассмотрим доказательства, свидетельствующие о ноотропной роли MС.
2. История, механизмы и текущие показания метиленового синего
МС был первоначально синтезирован Хайнрихом Каро в качестве красителя для текстиля, но вскоре было обнаружено, что он находит широкое применение в области медицины [1]. Ранние новаторские исследования включали его использование в качестве медицинского красителя, за которым вскоре последовало его применение Эрлихом и Гуттманом для лечения малярии [6]. Этот эффект сделал его важным наркотиком во многих военных кампаниях, хотя побочный эффект синей мочи не был особенно хорошо воспринят. Хотя выделение мочи синего цвета было нежелательно для солдат, оно было очень полезно в психиатрии; включенный в состав лекарственного средства, MС обеспечивал видимый индикатор соблюдения режима лечения [1,7]. Такой показатель был неоценим при исторически жестком лечении психических больных на ранних препаратах, чреватых нежелательными побочными эффектами. Благодаря этому применению в психиатрии в конечном итоге было обнаружено, что сам по себе MС оказывает антипсихотическое действие, что привело к развитию трициклических препаратов. MС использовался в качестве пилотной молекулы, открывая новую эру психофармакологии [1,8]. Известно, что некоторые из этих эффектов связаны с его функцией мощного ингибитора моноаминоксидазы (ИМАО), но недавняя работа выявила роль митохондриальных механизмов и метаболических манипуляций как источника, по крайней мере, некоторых полезных психиатрических эффектов препарата [9 ,10]. В последние годы эта работа расширила психиатрическое применение MС для лечения резидуальной биполярной депрессии [11].
Эти результаты предполагают, что MС обладает биодоступностью для головного мозга, что подтверждается фармакокинеическими исследованиями. МБ лучше всего вводить внутривенно, в/в. введение обеспечивает более высокие концентрации в крови и AUC, чем пероральное введение, и имеет период полувыведения примерно 6,6 часов. Независимо от пути введения, MС накапливается в значительных концентрациях в различных тканях, при этом концентрация MС в тканях головного мозга в десять раз превышает уровень в сыворотке уже через 1 час после внутривенного введения. администрации. Поглощение тканями происходит быстро, значительное накопление в органах отмечается через 3 минуты в легких, печени, почках и сердце. Биодоступность также модулируется статусом окисления, поскольку стабилизированная версия восстановленной формы MС демонстрирует заметно повышенное поглощение мозгом, что было учтено в недавнем клиническом испытании, которое будет обсуждаться в следующем разделе.
В настоящее время основными медицинскими применениями MС являются метгемоглобинемия, вазоплегический синдром, хирургическое окрашивание и нейротоксичность ифосфамида. Метгемоглобинемия вызвана преобладанием метгемоглобина (met-Hb), формы гемоглобина (Hb), в которой железосодержащий центр гемовой группы окисляется до трехвалентного состояния. Это может быть унаследовано или вызвано воздействием токсинов окружающей среды или некоторыми наркотиками, такими как амилнитрит. Метгемоглобинемия проявляется усталостью, головными болями, головокружением и синеватой кожей и может привести к судорогам и смерти при отсутствии лечения. Как только MС восстанавливается до лейкометиленового синего (leucoMB) в эритроцитах, leucoMB может восстанавливать met-Hb до Hb, повторно окисляясь до MС. Наиболее ярко это проиллюстрировано в случае Блю Фугейтс, семьи из сельского Кентукки, известной синей кожей в результате наследственной метгемоглобинемии. Лечение быстро уменьшило синий оттенок их кожи, к их большому облегчению.
Хотя метгемоглобинемия является одним из наиболее распространенных применений MС, другие его применения неоценимы. В качестве клинического окрашивания MС дает поразительные результаты при обнаружении нервов и свищей и обычно используется в нескольких процедурах, а также при гистологическом окрашивании. MС также можно использовать в качестве дополнительной терапии для химиотерапии ифосамидом, распространенным химиотерапевтическим агентом с вредными неврологическими побочными эффектами из-за нарушения митохондриальной цепи переноса электронов (ETC). В качестве альтернативного переносчика электронов MС может способствовать функционированию митохондрий, ограничивая нейротоксические эффекты препарата [20]. Наконец, вазоплегический синдром представляет собой опасное для жизни состояние, возникающее после искусственного кровообращения и проявляющееся в виде значительного снижения артериального давления, особенно распространенного у пациентов с историей приема ингибиторов ангиотензинпревращающего фермента. Введение MС может помочь в этом состоянии путем ингибирования гуанилатциклазы и синтазы оксида азота, повышая артериальное давление. Благодаря этим важным и необходимым медицинским применениям MС признан Всемирной организацией здравоохранения одним из необходимых лекарств, необходимых в базовой системе здравоохранения.
В митохондриях MС играет замечательную роль благодаря своей способности каталитического окислительно-восстановительного цикла. MС получает электроны от NADH через комплекс I, превращая его в бесцветный восстановленный аналог лейкометиленового синего (leucoMB) (рис. 1). LeucoMB напрямую переносит эти электроны на цитохром с, повторно окисляясь в процессе до MС, готового начать цикл заново. Даже при ингибировании комплекса I с помощью ротенона MB может обходить блокировку ЭТЦ в комплексах I и III, способствуя дыханию (рис. 2). Окислительное повреждение, являющееся причиной и следствием митохондриальной дисфункции, повреждает в первую очередь комплекс IV, а также комплекс I. Эту блокировку также обходит MС, так как он может значительно повышать активность комплекса IV. Экспрессия субъединиц комплекса IV впоследствии повышается, возможно, за счет индукции ядерного респираторного фактора 1 (Nrf1), который, как было обнаружено, повышен у старых мышей, получавших MB. Это увеличение может быть связано с инактивацией PTEN за счет умеренного увеличения продукции H2O2 или ингибирования GSK-3, увеличивая экспрессию NRF1 ниже пути NRF2/ARE.

Рисунок 1
Химическая структура метиленового синего и лейкометиленового синего

Рисунок 2
Схема MB как альтернативного митохондриального переносчика электронов
Электроны в митохондриальной цепи переноса электронов передаются от комплекса I к комплексу IV, обеспечивая трансмембранный потенциал для производства АТФ комплексом V. Утечка электронов из комплекса I и комплекса III действует как основной клеточный источник продукции АФК. MB был продемонстрирован как альтернативный митохондриальный переносчик электронов для перенаправления электронов непосредственно от комплекса I к комплексу III, избегая утечки электронов и последующего образования АФК. Это значительно облегчает активность комплекса IV, усиливая митохондриальное дыхание.
Этот окислительно-восстановительный цикл может напрямую защищать от окислительного стресса при патологических состояниях, сопровождаясь усилением передачи сигналов ядерного фактора (эритроидного происхождения 2), подобного элементу 2/антиоксидантного ответа (Nrf2/ARE). В физиологических условиях MB также активирует Nrf2/ARE с соизмеримым увеличением антиоксидантной защиты в результате умеренного, полезного увеличения производства H2O2 [30]. Механизмы МБ в контексте конкретных условий будут подробно обсуждаться в следующих разделах.
3. Метиленовый синий, митохондриальная дисфункция и нейродегенерация
Мозг в значительной степени зависит от окислительного метаболизма как источника энергии, потребляя 20% глюкозы в организме и 20% кислорода в состоянии покоя [31]. Поддержание мембранного потенциала покоя, генерация потенциалов действия и постсинаптическое действие глутамата составляют основную часть этой потребности в энергии, которая тесно связана с активностью нейронов [32,33]. Учитывая поразительное отсутствие альтернативных источников энергии в мозге, правильное функционирование митохондрий необходимо для здоровья мозга. Дисфункциональные митохондрии, наоборот, вовлечены в несколько нейродегенеративных состояний, играя либо причинную, либо способствующую роль [4].
Основная функция митохондриальной ЭТЦ заключается в поэтапном переносе электронов высокой энергии от энергетических субстратов, полученных из пищи, таких как НАДН, к О2. Каждый шаг высвобождает энергию, которая используется для транспорта протонов через внутреннюю митохондриальную мембрану, создавая трансмембранный потенциал, который приводит в действие АТФ-синтазу, молекулярный ротор, который превращает АДФ в АТФ [23,34]. Правильная работа митохондрий зависит от последовательного прохождения электронов через каждую ступень ЭТЦ. Когда ETC становится максимально занятым, переносчики электронов начинают отдавать электроны O2, производя вредные АФК [34].
Радикалы супероксида, образующиеся в результате утечки электронов, сами по себе повреждают, но они могут реагировать с оксидом азота (NO), генерируемым синтазой оксида азота, с образованием высокореакционноспособного пероксинитрита (ONOO-). ONOO- может вызвать обширное повреждение клеточных липидных компонентов, что особенно влияет на чувствительные олигодендроциты и их предшественники [35,4]. Анионы супероксида могут быть преобразованы в H2O2 с помощью супероксиддисмутазы, но это также может быть преобразовано в более опасный продукт – гидроксильные радикалы [34]. После образования эти молекулы вызывают в значительной степени вредные модификации множества клеточных компонентов.
Белки часто становятся мишенью атаки свободных радикалов. Модификации белков с помощью ROS/RNS включают, но не ограничиваются: окислением, нитрозилированием, ацетилированием и фосфорилированием [36]. Поскольку митохондрии являются источником АФК и содержат несколько металлопротеинов, которые могут катализировать образование АФК, таких как гидроксильные радикалы, они сильно страдают от окислительного повреждения [34]. Митохондриальные компоненты ETC являются мишенями окислительного повреждения, что приводит к прогрессирующей метаболической деградации, способствующей нейродегенерации [37] (рис. 3).

Рисунок 3
МС в нейродегенерации
MС может защищать от апоптоза нейронов, подавляя митохондриальную дисфункцию и последующее окислительное повреждение и снижение уровня АТФ. MС поддерживает нейрогенез, уменьшая нейровоспаление и стимулируя рост нейритов и синаптогенез. Таким образом, MС может предотвратить повреждение нейронов и может способствовать восстановлению нейронов.
Функция митохондрий также зависит от динамики деления/слияния и митофагии, основные компоненты которой могут быть повреждены нитроксидативным повреждением [38]. Динамика деления/слияния регулируется ГТФазами семейства динаминов и служит для поддержания митохондриальной функции путем обмена митохондриальными компонентами и деградации поврежденных митохондрий посредством митофагии [4]. Окислительное повреждение родственного слиянию белка OPA1 приводит к перемещению в цитозоль с последующей фрагментацией митохондрий [39]. Фрагментация митохондрий распространена при некоторых нейродегенеративных заболеваниях, что будет более подробно обсуждаться в последующих разделах этого обзора [40]. Митохондриальный транспорт неразрывно связан с динамикой деления/слияния, и показано, что он нарушается при нейродегенеративных заболеваниях [4,41].
Все эти пагубные эффекты усугубляются повреждением мДНК, что приводит к повреждающим мутациям, гетерогенно распределенным среди митохондрий в одной клетке. Это повреждение препятствует надлежащему восстановлению митохондрий за счет упреждающего отключения белков до их трансляции. Это гарантирует, что повреждение митохондрий будет длительным и может даже распространяться во время событий деления/синтеза [42]. Эти мутации дополнительно усугубляются нарушением динамики деления/слияния и неправильной регуляцией митофагии [34]. Важно отметить, что все эти повреждения могут увековечивать друг друга по принципу прямой связи, приводя к прогрессирующей митохондриальной дисфункции, которая способствует неумолимому прогрессу нейродегенерации [38].
3.1 Метиленовый синий и ишемическое поражение головного мозга
Как отмечалось ранее, мозг чрезвычайно чувствителен к недостатку кислорода и глюкозы в результате его высоких энергетических потребностей [31]. Ишемия, или прекращение притока крови к мозгу, может быть очаговой или глобальной. Глобальная церебральная ишемия (GCI) представляет собой полную потерю мозгового кровотока (CBF) и возникает во время травмы, такой как остановка сердца, асфиксия, кардиохирургия и гипотензивный шок. Остановка сердца требует быстрого вмешательства; даже при реанимации это обычно смертельно, с летальностью более 90%. Тех, кто выживет, ждет множество возможных инвалидностей. Выжившие должны бороться с сенсомоторным дефицитом, нарушением регуляции настроения, потерей памяти и снижением когнитивных функций, которые являются результатом отсроченной гибели нейронов по всему мозгу, особенно в гиппокампе [74,75].
Единственным показанным в настоящее время вмешательством для предотвращения гибели клеток, вызванной GCI, является терапевтическая гипотермия (TH), которая замедляет окислительный метаболизм и потенциально смягчает вызванный реперфузией окислительный стресс и митохондриальный сбой [76,77] [78]. Ранняя индукция TH является обязательной, поскольку TH дает убывающую отдачу с увеличением продолжительности после GCI. Кроме того, для индукции ТГ требуется существенное специализированное оборудование и подготовка персонала для предотвращения значительных побочных эффектов [79]. Это ограничивает развертывание, требуя исследования альтернативных методов лечения, которые могут быть развернуты с большей легкостью и доступностью.
Очаговая церебральная ишемия, или инсульт, происходит почти каждые 40 секунд в Соединенных Штатах и убивает или значительно ухудшает состояние 60% пациентов. Инсульт влечет за собой тяжелые эмоциональные, медицинские и экономические потери, которые ежегодно обходятся в США почти в 33 миллиарда долларов [80]. Существует две основные категории инсульта: ишемический и геморрагический [80]. Большинство инсультов являются ишемическими, возникающими в результате закупорки церебральной артерии, обычно вследствие атеротромбоза [80]. Центральное ядро ишемизированной области быстро подвергается преимущественно некротической гибели клеток, в то время как окружающая область полутени подвергается прогрессирующей энергетической недостаточности, воспалению и отсроченной апоптотической гибели клеток [81].
В настоящее время существует только одно показанное вмешательство в терапии инсульта — тромболизис с использованием тканевого активатора плазминогена (tPA) [82–84]. Это обусловливает необходимость правильной диагностики с помощью методов визуализации головного мозга, которые поглощают 4-часовое временное окно, в течение которого можно спасти очаг инфаркта [83]. Поскольку инсульт часто не идентифицируется с этим временным окном, крайне необходимы фармакологические стратегии, которые могут свести к минимуму или предотвратить дегенерацию нейронов, особенно те, которые можно легко и дешево применить.
Церебральная ишемия, очаговая или глобальная, протекает с двумя фазами повреждения: ишемией и реперфузией. Во время начального начала ишемии энергетическая недостаточность сначала нарушает поддержание потенциала мембраны нейронов. Последующая деполяризация вызывает чрезмерное высвобождение глутаматергической кислоты, что вызывает быстрый приток Са2+. Резкое повышение уровня внутриклеточного Са2+ активирует фосфолипазы, кальпаины и катепсины, повышает активность ЦОГ-2 и NOS и вызывает прекращение синтеза белка [85,86]. Между тем, когда митохондриальное дыхание останавливается, утечка электронов генерирует АФК, которые повреждают митохондриальные и клеточные компоненты как нейронов, так и соседних клеток. Сосудистый эндотелий реагирует на это окислительное повреждение и локальное высвобождение воспалительных факторов путем проницаемости и нарушения целостности гематоэнцефалического барьера (ГЭБ) [87].
При реперфузии кислород и энергетические субстраты возвращаются в уже не функционирующие митохондрии. Дыхание возобновляется в дефектных митохондриях, высвобождая постоянно увеличивающиеся уровни АФК, что еще больше усугубляет окислительное повреждение. Пермеабилизация ГЭБ позволяет циркулирующим макрофагам инфильтрировать и поддерживать локальное воспаление [4]. Все это время микроглия и астроциты реагируют посредством глиальной активации, высвобождая во внеклеточную среду свои собственные воспалительные факторы [88]. Со временем этот самовоспроизводящийся цикл в конечном итоге проявляется в виде апоптотической гибели клеток в полутени при фокальной ишемии или в особенно чувствительных областях, таких как гиппокамп, при GCI [89]. Очевидно, что здоровье митохондрий является важным фактором дегенерации нейронов. Таким образом, митохондриальная дисфункция стала привлекательной мишенью для нейропротекции против ишемического инсульта.
Было показано, что MС оказывает нейропротекторное действие в нескольких моделях ишемического повреждения, отчасти благодаря его антиоксидантной способности и способности способствовать альтернативному переносу митохондрий. Тем не менее, большая часть работы в этой области была сосредоточена на ингибировании МС активности NOS. Большая часть этой работы была проделана на моделях остановки сердца у поросят в лаборатории Виклунда. В 2007 году они продемонстрировали, что введение MС в модели остановки сердца у поросят может значительно увеличить выживаемость в течение 5 часов, если их доставить через 1 минуту после реанимации. Интересно, что они отметили, что MС преодолевает гематоэнцефалический барьер, а позже обнаружили, что он может сохранять целостность ГЭБ [90,45]. Позже эта группа обнаружила, что лечение MС увеличивает системное кровообращение за счет ингибирования NOS и снижает показатели перекисного окисления липидов и воспаления. Эти защитные эффекты наблюдались как в мозговой, так и в сердечной ткани на модели свиньи [45]. Нейропротекторные эффекты MС значительно усиливались в сочетании с гипотермией как у свиней, так и у грызунов [46,47], возможно, из-за поддержания правильной функции митохондрий при замедлении метаболизма и индукции гипотермических клеточных ответов [91]. Возможно, что эффективность ТГ может быть повышена при добавлении промотора митохондриальной функции, особенно того, который может смягчить окислительное повреждение. Однако необходимы дополнительные доказательства, чтобы сделать убедительный вывод о перспективах комбинированной терапии МС+ТГ.
Исследования клеточных культур из других лабораторий показали, что некоторые нейропротекторные эффекты MС связаны со стабилизацией Hif-1α и фосфорилированием пути Akt [44]. Некоторые эффекты могут быть связаны с ингибированием каспаз. MС также может окислять функциональный остаток цистеина как на каспазе-3, так и на каспазе-6, предотвращая их протеолитическое действие [48]. Этот феномен также может лежать в основе нейропротекции МС и требует дальнейшего изучения.
Те же самые митохондриальные нейрозащитные механизмы MС, продемонстрированные в GCI, также продемонстрировали эффективность на нескольких животных моделях инсульта. MС может увеличить церебральный кровоток в гипоперфузированной ткани в постоянной модели MCAO у крыс, блокируя сосудорасширяющее действие NO посредством ингибирования GC и NO-синтазы, предотвращая эскалацию развития полутени [52,49]. Лежащий в основе митохондриальный механизм MС был подтвержден на моделях инсульта с повышенным поглощением O2, комплексной активностью IV и содержанием АТФ [54,50,51]. Другая работа неоднократно показывала, что размер инфаркта можно контролировать или уменьшить с помощью MС, и что эта защита соизмерима с улучшенными поведенческими результатами в моделях грызунов [44,53]. Механизмы, с помощью которых это достигается, разнообразны.
В вышеупомянутом исследовании было показано, что MС удалось восстановить митохондриальную структуру и потенциал митохондриальной мембраны при сохранении митофагии [51]. Подобные исследования связывают индукцию аутофагии MС с активацией mTOR и фосфорилированием AKT [44,92]. Примечательно, что недавняя работа по применению MС при субарахноидальном кровоизлиянии, форме геморрагического инсульта, заметно недостаточно представленной в исследованиях MС, показала аналогичное увеличение фосфорилирования AKT и GSK-3β, которое сопровождалось улучшением неврологической функции и уменьшением нейровоспаления [55]. Повсеместно было обнаружено, что MС ингибирует проапоптотические пути и обеспечивает нейрозащиту от гибели клеток в области полутени, в некоторых случаях сохраняя критические клеточные структуры, такие как концевые ножки астроцитов [93,50].
Как упоминалось ранее, работа в нашей лаборатории показала, что MС может способствовать нейропротекции за счет снижения активации каспазы и защиты потенциала митохондриальной мембраны. Результаты также коррелировали с улучшенными поведенческими характеристиками в лабиринте Барнса, классическом тесте пространственной памяти, зависящей от гиппокампа [43]. В нашей дальнейшей работе лечение МБ применялось к модели фототромботического инсульта у крыс. Мы продемонстрировали нейрозащиту от гибели нейронов, а также стимулирование нейрогенеза, вызванного инсультом. Эти результаты были параллельны уменьшению воспаления в микросреде [54]. Мы предполагаем, что это результат роли митохондрий в нейрогенезе, которая будет обсуждаться более подробно в следующем разделе.
Комбинированная терапия изучается с большим интересом, несмотря на присущую ей сложность дизайна исследования. Новый пример комбинированного лечения нормобарической гипероксии с MС. Комбинированная терапия уменьшила объем инфаркта и привела к поведенческим улучшениям в модели инсульта по сравнению с любым лечением по отдельности [56]. Наша работа показала, что добавление MС к терапевтической гипотермии помогло спасти гибель нейронов и поведенческие результаты после расширенного GCI. Более того, комбинированная терапия значительно снижала активацию глии, воспаление и пути апоптоза каспазы-3. Это было связано с улучшением митохондриальной дисфункции. Все эти эффекты заметно усиливались при комбинированной терапии по сравнению с любой монотерапией [46]. Поэтому вполне вероятно, что комбинированная терапия является ключом к максимизации полезных эффектов MС, особенно с учетом широкого диапазона и разнообразия ишемического повреждения головного мозга, в частности инсульта. Если MС действительно окажется успешным в лечении ишемического повреждения головного мозга, локального или глобального, он может открыть эффективное лечение в различных медицинских учреждениях из-за его повсеместного распространения во всем мире.
3.2 Метиленовый синий и болезнь Альцгеймера
БА представляет собой прогрессирующее нейродегенеративное заболевание, поражающее 1 из 9 человек старше 65 лет и приводящее к потере памяти, снижению когнитивных функций, тяжелой инвалидности и смерти [70]. В настоящее время не существует эффективного лечения БА, которое могло бы остановить или значительно замедлить неумолимое ухудшение состояния пациента. В этом отношении это делает БА уникальным среди основных убийц в США, поскольку это одна из немногих основных причин смерти с небольшими профилактическими или терапевтическими мерами [70]. Учитывая рост сообщества пожилых людей в результате более качественного и доступного здравоохранения, важность терапевтических возможностей для лечения болезни Альцгеймера со временем будет только возрастать. Крайне важно разработать лекарства, которые могут воздействовать на ключевые механизмы или несколько механизмов в случае MС.
АтД классически характеризуется гистологически накоплением сенильных бляшек, олигомеров β-амилоида (Aβ) и нейрофибриллярных клубков (NFT), состоящих из гиперфосфорилированного тау-белка [70]. Aβ является продуктом протеолитического расщепления мембраносвязанного белка-предшественника амилоида (APP) последовательно γ-секретазой и β-секретазой. Процессинг АРР Aβ может происходить по одному из двух путей: амилоидогенному и неамилоидогенному пути [94]. Неамилоидогенный путь начинается с расщепления АРР α-секретазой, что дает растворимый N-концевой фрагмент, sAPP-α, и связанный с мембраной С-концевой фрагмент (CTF-α). CTF-α далее процессируется γ-секретазой с образованием другого N-концевого растворимого фрагмента, p3. Растворимые фрагменты, генерируемые этой последовательностью, не образуют агрегатов и не являются нейротоксичными. Однако амилоидогенный путь начинается с расщепления АРР β-секретазой с образованием sAPP-β. Расщепление γ-секретазой оставшегося фрагмента CTF-β генерирует Aβ, который постепенно агрегирует из олигомеров в бляшки, которые накапливаются внеклеточно, нарушая клеточную функцию и активируя воспалительные пути [94]. Олигомерный Аβ также накапливается внутриклеточно, локализуясь в митохондриях, способствуя митохондриальной дисфункции и энергетической недостаточности, характерным для патологии БА [95].
Классически основной подход к терапевтическим исследованиям при БА был нацелен на Aβ. МС совсем недавно, в 2007 году, начали изучать в этом качестве. Ранние работы показали, что MС может способствовать фибрилляции Aβ, тем самым подавляя образование нейротоксического олигомерного Aβ, хотя более поздние исследования in vitro были противоречивыми [96,67]. Работа, проведенная на трансгенных мышах (3xTg-AD), показала, что MС поддерживает протеолитический клиренс Aβ за счет повышения активности химотрипсина и трипсиноподобной протеасомы в головном мозге [64]. Уменьшенное отложение Aβ в гиппокампе и соседней коре головного мозга наблюдалось в другой модели трансгенных мышей (APP/PS1), и эти наблюдения были подтверждены соразмерной защитой от снижения когнитивных функций в поведенческих задачах, измеряющих социальное взаимодействие, обучение и память, а также исследовательскую активность [61]. Аналогичные результаты были получены на трансгенных мышах PSAPP, у которых было установлено, что антиамилоидогенный механизм связан с ослаблением активности и экспрессии β-секретазы [60].
Митохондриальная дисфункция на ранних стадиях патологии БА проявляется до значительного отложения бляшек и снижения когнитивных функций [97–99]. Активность дыхательной цепи затруднена, особенно в комплексах III и IV, что приводит к снижению энергетического метаболизма в пораженных участках [98, 100, 101]. Известно, что растворимый Aβ колокализуется в митохондриях и импортируется митохондриальным комплексом импорта, TIM/TOM [102,103]. Оказавшись в митохондриях, Aβ действует на несколько молекулярных мишеней, включая Aβ-связывающую алкогольдегидрогеназу (ABAD) и комплекс IV, вызывая повреждение ETC и последующую выработку АФК, что приводит к нарушению потенциала митохондриальной мембраны [104, 63, 105, 103].
Помимо повреждения клеточных компонентов, Аβ-индуцированная генерация АФК также служит для индукции митохондриальной фрагментации в результате s-нитрозилирования Drp1 [106]. Это изменение в митохондриальной динамике сопровождается снижением аксонального митохондриального транспорта [104]. Aβ также приводит к повышению уровня митохондриального Ca2+, что может индуцировать открытие mPTP, высвобождение цитохрома с и фактора, индуцирующего апоптоз (AIF), которые запускают индукцию путей гибели клеток [97] . Эти особенности указывают на поразительное клиническое значение митохондриальной недостаточности при БА, а также на потенциальную мишень для терапевтических средств, таких как MС.
Хорошо известно, что MB способствует активности комплекса IV и митохондриальной активности, и этот эффект распространяется на мозг AD [107,26]. Одним из основных механизмов MС является стимулирование активности комплекса IV посредством циклирования электронов, но способствующим фактором является активация синтеза гема [63,107]. В крысиной модели AD со стрептозотоцином (STZ) увеличение продукции комплекса IV и АТФ отражалось в улучшении когнитивного дефицита, вызванного повреждением гиппокампа [57]. Было показано, что MС снижает маркеры окислительного стресса в нескольких моделях AD с помощью методов электронного циклирования и ингибирования нижестоящих механизмов и взаимодействий [57, 108, 109].
Одним из таких методов является ингибирование связывания Aβ-ABAD, предотвращающее связанный с этим выход АФК, отказ MMP и последующую гибель клеток [109–111,103]. Стимулирование митохондриальной функции может предотвратить цитозольное высвобождение факторов, вызывающих смерть, но MС может сделать эту защитную меру еще на один шаг, дезактивируя каспазы посредством окисления функционального цистеина. MС также нацелен на другие признаки расстройства, NFT и Aβ-бляшки. Принимая во внимание прогрессивную обратную связь почти каждого аспекта механизмов БА, эти более широкие механизмы смягчают дальнейшие митохондриальные нарушения.
Другой важной особенностью БА является наличие NFT, агрегатов гиперфосфорилированного тау-белка (р-тау). Тау представляет собой белок, ассоциированный с микротрубочками, который широко распространен в ЦНС, стабилизируя микротрубочки нейронов. Тау является мишенью фосфорилирования для киназ, таких как киназа гликогенсинтазы 3β (GSK3β), киназа c-Jun (JNK) и циклинзависимая киназа 5 (cdk5) [112–114]. В то время как фосфорилирование тау является физиологическим процессом, чрезмерное фосфорилирование тау является патологическим и способствует деградации нейронов при БА.
При чрезмерном фосфорилировании тау диссоциирует от микротрубочек, вызывая их дестабилизацию и последующее растворение. При этом сам p-tau агрегирует в клубки [115]. При нарушении сетей микротрубочек нарушается клеточная функция и аксональный транспорт, например, вышеупомянутый дефицит митохондриального транспорта [116]. Клиренс через протеасомы также затруднен. Хотя p-tau сильно убиквитинилирован, p-tau продолжает накапливаться в избытке, который может очистить протеасома [117,116]. Горячо обсуждается вопрос о том, предшествует ли таупатия патологии Aβ или является ее следствием, как и ее точный вклад в патологию. Несмотря на это, ясно, что агрегация тау играет жизненно важную роль при БА, и устранение ее дисфункции является важной темой изучения.
Пионерская работа по применению MС при БА была проведена Клодом Вишиком, в ходе которого его лаборатория обнаружила, что MС обращает вспять агрегацию тау, блокируя связывание тау-тау, хотя и в дозах, превышающих клинически значимые уровни [66]. MС и его производные уменьшали накопление тау-филаментов в анализе in vitro, что, как позже выяснилось, было связано с ингибированием образования филаментов на первом и четвертом повторяющихся пептидах в домене, связывающем тау-микротрубочки [68,118]. В отличие от других родственных красителей, MС не связывается и не ассоциируется с протофибриллами тау [119]. Он предотвращает фибрилляцию, окисляя остатки цистеина в тау, заставляя их образовывать более стабильную мономерную форму, устойчивую к агрегации [69].
Кроме того, также было замечено, что MС способствует удалению тау-филаментов, индуцируя аутофагию [65]. Многочисленные исследования показали, что MС помог снизить нагрузку тау в различных моделях трансгенных мышей с таупатией при краткосрочном и долгосрочном лечении, и что этот клиренс был связан с улучшением когнитивного дефицита [58,62]. При превентивной доставке MС может предотвратить снижение когнитивных функций и накопление тау у трансгенных мышей, экспрессирующих проагрегантный человеческий тау [120].
Исследования с применением МС на различных моделях животных дали интересные, хотя и несколько противоречивые результаты. MС не удалось снизить нагрузку тау в модели рыбок данио, хотя он показал многообещающие результаты в снижении агрегации гентингтина [121]. В модели трансгенной тауопатии C. elegans MB удаляли тау и способствовали правильному митохондриальному транспорту, который сопровождался повышенной подвижностью [122].
MС применялся в клинических испытаниях на людях, начиная с фазы 2 клинических испытаний MС под названием «Rember». Исследование показало улучшение как когнитивных функций, так и мозгового кровотока у пациентов с БА легкой и средней степени тяжести [59]. Был разработан вариант молекулы лейкометилтиониния бис (гидрометансульфонат), или LMTM, более стабильный в восстановленной форме [15]. К сожалению, последующее 15-месячное исследование фазы 3 LMTM дало отрицательные результаты [14]. Ожидается еще одно исследование LMTM в легких случаях БА. Эти и другие исследования могут дополнительно пролить свет на защитные механизмы МС против БА и могут однажды привести к клиническому воплощению.
3.3 Метиленовый синий и болезнь Паркинсона
Болезнь Паркинсона (БП) представляет собой прогрессирующее нейродегенеративное заболевание, возникающее в результате гибели дофаминергических нейронов в черной субстанции (ЧС), клинически проявляющееся тремором, ригидностью, нарушением движений, плоским лицом и депрессией [4]. Заболевание обычно возникает после 50 лет, поражая 100–300 человек из каждых 100 000, проявляя двигательные симптомы у большинства пациентов [123]. БП снижает ожидаемую продолжительность жизни пациентов, при этом возраст начала значительно влияет на прогноз; у пациентов с ранним началом ожидаемая продолжительность жизни снижается на 10 лет, а у пациентов с поздним началом — около 5 лет ожидаемой продолжительности жизни [124]. Смертность при БП обычно является результатом падений или респираторных инфекций и отеков, часто возникающих в результате случайной аспирации пищи из-за затрудненного глотания [125–127].
Лечение болезни Паркинсона обычно заключается во введении предшественника дофамина леводопы, которая уменьшает ригидность и тремор. К сожалению, терапия леводопой сопровождается неврологическими и поведенческими побочными эффектами, и в ходе лечения обычно требуются постоянно увеличивающиеся дозы и вторичные препараты [128]. Левадопа, хотя и жизненно необходима пациентам, является паллиативным средством и не замедляет прогрессирование заболевания. Таким образом, крайне важно разработать методы лечения, которые могут воздействовать на ключевые механизмы повреждения нейронов, чтобы остановить или обратить вспять течение болезни.
Гистологическим признаком болезни Паркинсона является наличие телец Леви и нейритов Леви, внутриклеточных агрегатов белка α-синуклеина (α-син) [4]. Эти агрегаты в значительной степени связаны с изменениями экспрессии убиквитинлигазы E3, Parkin, которая вызывает дефицит контроля качества митохондрий, препятствуя переносу микротрубочек [129]. A-syn при перемещении в митохондрии может нарушать функцию как комплекса I, так и комплекса IV ETC, что приводит к прогрессирующей митохондриальной дисфункции, которая усиливается недостаточностью митофагии [130,131]. Эта дисфункция ETC является основой, на которой генерируются две из наиболее широко используемых моделей симптомов БП: MPTP и ротенон, оба из которых ингибируют комплекс I [5, 132]. Эти токсины вызывают характерное повреждение дофаминергических нейронов ЧС и проявляют паркинсонический тремор [132]. Как и при всех нейродегенеративных заболеваниях с митохондриальным механизмом, терапевтические стратегии, нацеленные на такую дисфункцию, предлагают заманчивое направление исследований.
Основополагающая работа, которая определила альтернативную способность переноса электронов MС, была обнаружена с использованием ротеноновой модели PD. Наряду с упомянутым выше сохранением функции ЭТЦ лечение МС сопровождалось поведенческими улучшениями в треморе, локомоции, осанке и двигательных навыках [5]. Помимо этого исследования, доказательства эффективности при БП являются косвенными, но все же многообещающими. Как митофагия, так и общая аутофагия индуцируются введением MС, что может смягчить дефицит контроля качества митохондрий, который приводит к прогрессированию заболевания [51,65]. Более того, установленные антиоксидантные и стимулирующие ETC функции MС в митохондриях нацелены на те самые комплексы, на которые больше всего нацелена PD [27,5,133].
С его низким профилем побочных эффектов существует вероятность того, что MС, вводимый профилактически или на ранних стадиях болезни Паркинсона, может предотвратить прогрессирование расстройства из-за полезных эффектов низких уровней H2O2, генерируемых MС в физиологических условиях, опосредованных Путь Nrf2/ARE, который предположительно связан с болезнью Паркинсона [134, 135, 30]. Наконец, свойства MС, связанные с ИМАО, могут обеспечить дополнительные преимущества при постоянном приеме леводопы, хотя профиль безопасности этой комбинации требует тщательного изучения [136, 128]. Тесная связь профиля митохондриальных эффектов MС и митопатии, присутствующей при БП, кажется многообещающей, подчеркивая необходимость применения MС к различным химическим и генетическим моделям животных при БП.
3.4 Метиленовый синий при черепно-мозговой травме
В последние годы TBI вновь привлек внимание общественности из-за того, что спортивные травмы и солдаты, возвращающиеся из зон активных боевых действий по всему миру, стали заметными. Черепно-мозговая травма является серьезной причиной смерти и инвалидности, ежегодно регистрируя около 2 миллионов случаев в Соединенных Штатах [137]. ЧМТ является результатом сильной травмы головы, хотя это простое объяснение противоречит неоднородному характеру состояния. Травма ЧМТ состоит из двух фаз: первичной и вторичной. Первичным повреждением является само механическое повреждение, которое вызывает смещение аксональных путей, разрыв микроциркуляторного русла и сдавление мозговой ткани. Со временем развивается вторичное повреждение, включающее повышение внутричерепного давления, отек головного мозга, эксайтотоксичность, прогрессирующее воспаление, активацию глии, метаболическую недостаточность, судороги и ишемическое повреждение [138,139]. Нарушения, вызванные ЧМТ, различаются в зависимости от силы удара; тяжелые случаи могут сопровождаться потерей сознания, долговременной потерей памяти и судорогами, в то время как «легкая» ЧМТ может проявляться спутанностью сознания, дефицитом внимания или когнитивных функций, а также нарушением сохранения памяти, хотя определение легкой ЧМТ несколько размыто [138, 140].
Большая часть клеточной патологии при ЧМТ имеет поразительное сходство с ишемическим повреждением головного мозга, и на то есть веские причины. Повышенное внутричерепное давление, нарушение регуляции мозгового кровообращения и нарушение микроциркуляторного русла служат для ограничения кровотока и последующей доставки кислорода в мозг, что приводит к энергетической недостаточности, эксайтотоксичности и митохондриальной дисфункции [141, 142]. Перепроизводство АФК приводит к прогрессирующему упадку митохондрий и хронической глиальной активации, способствуя возникновению известного паттерна митохондриальной нейродегенерации [143,144]. Механическое разрушение путей белого вещества усугубляет повреждение, нарушая аксональный митохондриальный транспорт. Дисфункциональные митохондрии после аксотомии выделяют избыточное количество АФК рядом с чувствительными, богатыми липидами олигодендроцитами, вызывая значительное перекисное окисление липидов и дальнейшее прогрессирование глиоза [145]. АФК и региональное воспаление вызывают пермеабилизацию ГЭБ за счет активации металлопротеиназ матрикса и снижения экспрессии белков плотных контактов. Это обеспечивает обратную связь и способствует воспалению и инфильтрации периферических макрофагов, снова усиливая экспрессию и высвобождение воспалительных факторов и воспалительных сигналов [146].
Эти процессы приводят к активации конкурирующих путей клеточной гибели, генерирующих фенотипы гибели в континууме от апоптоза до некроза [147]. Ориентация на эти пути оказалась сложной задачей. Терапевтическая гипотермия применялась так же, как и при GCI. В случае ЧМТ он эффективен для снижения внутричерепного давления, но применяются те же ограничения в технике и доступности [148]. Гипербарическая оксигенотерапия также изучалась с ограниченной эффективностью [149]. Значительное исследование было посвящено антиоксидантной терапии при ЧМТ, что дало многообещающие доклинические результаты. Эти результаты, к сожалению, не нашли подтверждения в клинических испытаниях [150]. Возможно, что многие неудачи лечения ЧМТ, а также других нейродегенеративных состояний связаны с дизайном доклинических исследований или различиями между видами. Особенно при инсульте и ЧМТ основным фактором может быть неоднородность травмы. Несмотря на это, окно для эффективных методов лечения широко открыто, и пациенты отчаянно нуждаются в нем.
В нескольких доклинических исследованиях изучалась терапия MС после легкой ЧМТ, но настоящие исследования обнадеживают. Первоначальные исследования показали, что MС, вводимый дважды вскоре после ЧМТ, может уменьшить объем инфаркта в течение нескольких временных точек, вплоть до 14 дней после ЧМТ. МС уменьшал соматосенсорный дефицит в поведенческих тестах и уменьшал гибель клеток в пораженной коре [72]. Это было подтверждено работой, показывающей, что лечение MС, проводимое в течение 15–30 минут после ЧМТ, может уменьшить отек головного мозга и воспаление в долгосрочной перспективе после ЧМТ. Неврологическая оценка улучшилась при MС, но никаких различий не было замечено в конкретных тестах на координацию движений [73]. Эти результаты обнадеживают, но стратегия дозирования нереалистична; крайне маловероятно, что у пациента с ЧМТ будет возможность провести почти немедленную инфузию MС.
К счастью, другие исследования показали, что лечение даже через 24 часа после ЧМТ может воспроизвести аналогичные улучшения размера инфаркта и неврологической функции [71]. Эти результаты были отражены и расширены в последующем исследовании с парадигмой множественного лечения, в которой лечение МС уменьшало отек, долгосрочный глиоз, гибель нейронов и размер инфаркта, защищая при этом от поведенческих нарушений. Более того, эти преимущества были связаны с усилением индукции аутофагии [70].
Эти и другие исследования, касающиеся ишемического повреждения, воодушевляют, поскольку пациенты с ЧМТ остро нуждаются в эффективных методах лечения, особенно таких недорогих и доступных, как MС. Однако из-за разнообразной природы черепно-мозговых травм маловероятно, что один агент обеспечит наиболее оптимальную защиту от совокупности патологий после ЧМТ. Таким образом, MС, вероятно, окажется наиболее эффективным в форме комбинированной терапии, как описано ранее в контексте GCI и инсульта. В настоящее время таких исследований не проводилось, но растущая литература по комбинированной терапии МС при других повреждениях головного мозга может стать прочной основой для разработки исследований, применимых к ЧМТ. Хотя эти исследования по своей сути будут сложными, перспектива эффективного лечения повреждения нейронов, вызванного ЧМТ, слишком важна, чтобы ее игнорировать.
4. Метиленовый синий в улучшении когнитивных функций, возрастном снижении когнитивных функций и нейрогенезе.
Когнитивное улучшение с помощью фармацевтических препаратов — это идея, которая давно привлекает внимание и воображение общественности. Эта концепция широко распространена в общественном сознании, и целые интернет-сообщества сосредоточены на концепции и исследовании потенциальных усилителей когнитивных функций, или ноотропов. Предлагаемые усилители когнитивных функций варьируются от добавок аминокислот до традиционно используемых травяных добавок [151, 152]. С этой целью часто злоупотребляют клинически назначенными стимуляторами, особенно в кампусах колледжей, что усиливает общественную стигматизацию законных пациентов и достоверность диагнозов синдрома дефицита внимания и гиперактивности в целом [153]. Очевидно, что расширение познания представляет значительный интерес как для общественности, так и для исследователей. Улучшение познания может оказаться в пользу общественного блага с точки зрения производительности и качества жизни, особенно в отношении пожилого населения. В свете этого дешевые доступные соединения, которые могли бы безопасно поддерживать или улучшать когнитивные функции, являются идеальными кандидатами. Поэтому MС в этом отношении является многообещающим соперником.
В последние годы все чаще исследуется концепция улучшения когнитивных функций посредством митохондриальной модуляции. Общая концепция заключается в том, что за счет улучшения митохондриальной функции и окислительной защиты нейроны могут функционировать с повышенной эффективностью и поддерживать надлежащее здоровье, улучшая базальную функцию и препятствуя снижению когнитивных функций, связанному с возрастом и нейродегенерацией [154]. Ранняя работа Gonzalez-Lima показала, что MС улучшает сохранение пространственной памяти наряду с длительной митохондриальной дыхательной функцией, опосредованной через комплекс IV [26]. Длительная активация CCO может быть связана с увеличением продукции H2O2 без образования супероксида через MС в физиологических условиях, что приводит к активизации Nrf2/ARE [135]. В исследовании на людях введение MС увеличивало цереброваскулярную реактивность в задаче на психомоторную бдительность и в тесте на кратковременную память. Это сопровождалось умеренными улучшениями в тесте кратковременной памяти [155]. Эти преимущества, коррелирующие с функцией митохондрий, подтверждаются экспериментами, показывающими аналогичное улучшение когнитивных функций при фотобиомодуляции, стимуляции комплекса IV транскраниальным лазерным излучением ближнего инфракрасного диапазона [156].
Метаболические расстройства хорошо зарекомендовали себя в головном мозге пожилых людей, особенно в областях, классически связанных с высшими функциями мозга [157–159]. Митохондриальные повреждения со временем накапливаются и постепенно способствуют угасанию нейронов с возрастом, как и при нейродегенеративных состояниях [158]. Эти митохондриальные нарушения включают в себя нарушение цепи переноса электронов, недостаточность митофагии и сдвиг в сторону чрезмерного деления, мутации мтДНК и чрезмерное производство АФК [158]. Эти особенности связаны с когнитивным дефицитом у пожилых людей, так же как и у людей с БА, НКИ, большим депрессивным расстройством и другими состояниями. Таким образом, защита здоровья митохондрий может обеспечить некоторую степень защиты от слабоумия или других форм возрастного когнитивного дефицита. MС, как подробно описано ранее, может блокировать или предотвращать многие из этих митохондриальных повреждений и, таким образом, может иметь потенциал для защиты когнитивных функций от разрушительного метаболизма с возрастом. Эта возможность до сих пор формально не исследовалась и остается открытым вопросом и областью научных исследований.
Хорошо известно, что нейрогенез происходит во взрослом возрасте как физиологический процесс и как ответ на травму [160]. После развития нейрогенез ограничивается тремя областями мозга: обонятельной луковицей, кортикальной субвентрикулярной зоной (СВЗ) и субгранулярной зоной (СГЗ) зубчатой извилины гиппокампа (ЗГ). Нарушение этого процесса связано с нарушением консолидации памяти и регуляции настроения и вовлечено в нейродегенерацию и возрастное снижение когнитивных функций, поскольку нейрогенез и связанные с ним процессы резко снижаются в пожилом возрасте [161]. Таким образом, стимуляция и поддержание нейрогенеза является заманчивой целью для возрастной деменции, учитывая существенные общие черты с другими патологическими формами нейродегенерации.
Нейрогенез также одновременно стимулируется и тормозится в условиях, протекающих после повреждения головного мозга [162]. В животных моделях инсульта нейрогенез стимулируется как в SVZ, так и в SGZ наряду с высвобождением эритропоэтина и как сосудистых, так и эпидермальных эпителиальных факторов роста, которые индуцируют пролиферацию клеток-предшественников нейронов (NPC) [162–164]. Новообразованные нейроны мигрируют в поврежденную область и пытаются функционально встроиться в существующую нейронную сеть, чтобы облегчить восстановление [165]. Восстановление нервной системы путем стимуляции нейрогенеза привлекательно, но ограничено реакцией микросреды на травму. Хроническое нейровоспаление и активация глии, обе особенности, связанные с преклонным возрастом [166], являются общими для большинства нейродегенеративных состояний, и оба эти фактора тормозят нейрогенез [166] [160, 167–171]. Этот дефицит нейрогенеза можно смягчить противовоспалительным лечением [172]. АФК, генерируемые реактивной глией, также повреждают и истощают пулы NPC [173]. Добавление антиоксиданта, как и противовоспалительная блокада, предотвращало истощение новообразованных нейронов [174]. Кроме того, целостность митохондрий имеет решающее значение для нейрогенеза и, таким образом, активируется во время пролиферации и дифференцировки [175]. Дефицит митохондрий, в основном проявляющийся в экспериментах с цибридами, демонстрирует заметные нарушения как пролиферации, так и дифференцировки [176-178].
Несколько исследований применяли MС к нейрогенезу, но те, которые применялись, а также общие действия MС предполагают потенциал для полезных эффектов. Ранее упомянутое исследование GCI с применением MС к модели поросят показало, что MС активировал гены, связанные с нейрогенезом, включая синаптогенез, рост нейритов и факторы выживания [91]. MС подавлял пролиферацию крысиных NPC, подавляя экспрессию циклина и активность mTOR. Это кажется противоречивым, но чрезмерная пролиферация истощает пул NPC, уменьшая будущую способность к нейрогенезу. МС также не влиял на дифференцировку нейронов. Эти результаты, однако, наблюдались у крыс первого дня жизни после рождения, поэтому неясно, применим ли этот защитный механизм к поврежденному мозгу взрослых особей [179]. Работа в нашей лаборатории показала, что MС, доставляемый после фототромботического инсульта, способствует нейрогенезу. Кроме того, он подавлял воспаление, глиоз и улучшал функцию митохондрий — все это способствует нейрогенному дефициту. Это наводит нас на мысль, что MС, возможно, могут способствовать или поддерживать нейрогенез после травмы, делая местное микроокружение более податливым для новообразованных нейронов, поддерживая при этом их митохондриальную эффективность [54]. В то время как поддержание выживания вновь образованных нейронов равносильно, поддержка их миграции также необходима для поддержания восстановления нейронов. Опять же, доказательства ограничены, но недавние данные указывают на то, что MС может модулировать миграцию взрослых нервных стволовых клеток мыши в анализе миграции клеток [180]. Необходимо гораздо больше доказательств, чтобы сделать убедительный вывод о влиянии и роли MB в стимуляции нейрогенеза у взрослых и митохондриального здоровья в пожилом возрасте. В случае подтверждения МБ может служить многогранным инструментом для сохранения когнитивных функций и качества жизни пожилого населения, что является жизненно важным демографическим фактором в стареющем обществе.
6. Побочные эффекты и противопоказания метиленового синего
МС явно перспективен в качестве терапевтического средства для лечения многих состояний, но, как и любое лекарство, он имеет ряд ограничений. Вазомодулирующие свойства MС полезны в терапевтических дозах, но сопряжены с риском при более высоких концентрациях. Эти риски варьируются от повышения артериального давления и сосудистого сопротивления до нарушений сердечной функции и ритма [2]. Точно так же MС может влиять на измерения пульсоксиметрии, препятствуя правильной диагностике.
Другим токсическим эффектом является индукция анемии у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы. Новорожденные также подвержены анемии и многим другим побочным эффектам в ответ на MС [2]. У новорожденных МС может вызывать гипербилирубинемию, проявляющуюся желтухой [181]. Это довольно прискорбно, так как общепринятым методом лечения гипербилирубинемии является фототерапия, которая активирует фотодинамическую активность МС. Это генерирует возбужденные формы кислорода, которые вызывают значительное повреждение эпидермиса [182]. Таким образом, при любом применении MС следует относиться с осторожностью к любому другому фотосенсибилизатору. У новорожденных лечение MС также может, как это ни парадоксально, привести к метгемоглобинемии [183].
Последний и наиболее клинически значимый побочный эффект у взрослых пациентов связан с использованием обычных психиатрических препаратов, селективных ингибиторов обратного захвата серотонина (СИОЗС). MС является сильнодействующим ИМАО, который в сочетании с СИОЗС может потенцировать серотониновый синдром, опасный для жизни неотложной медицинской помощи [184–186]. Учитывая повсеместное распространение пациентов, принимающих СИОЗС, целесообразно проводить скрининг пациентов на наличие этих препаратов перед введением MС. Несмотря на это, риски МС относительно низки и достаточно предсказуемы, что является хорошим предзнаменованием для адаптации в клинике.
7. Выводы
Нейродегенеративные расстройства представляют собой серьезную проблему в медицине, требующую больших потерь, как человеческих, так и финансовых. Относительная нехватка терапевтических вариантов по своей сути обескураживает, но именно эта вакансия должна стимулировать инновации. Борьба этих пациентов мотивирует преданных своему делу исследователей, а неиспользованный характер этого рынка должен побуждать инвесторов поддерживать эти усилия. Хотя эти амбиции могут быть омрачены менее чем звездным послужным списком, есть надежда на предприятия с меньшим риском в виде перепрофилированных фармацевтических препаратов, таких как MС. Отличные показатели безопасности MС хорошо зарекомендовали себя за столетие медицинского использования. Его недавно изученная роль в качестве митохондриального энхансера и рециркуляционного антиоксиданта является ключом к его потенциалу в качестве терапевтического агента. С обнадеживающими результатами доклинических испытаний некоторых из наиболее инвалидизирующих нейродегенеративных состояний, МС следует исследовать с новым энтузиазмом в ближайшие годы. Если эти результаты будут подтверждены в будущих исследованиях на людях, MС может оказаться универсальным средством, способным улучшить здоровье пациентов, страдающих от бремени нейродегенеративных заболеваний и травм головного мозга, давая им и их близким облегчение и лучшее качество жизни.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5826781/
(июнь 2018)
От митохондриальной функции к нейропротекции — новая роль метиленового синего
Абстракт
Метиленовый синий (МС) является хорошо зарекомендовавшим себя препаратом с долгой историей использования благодаря широкому спектру применения и минимальному профилю побочных эффектов. MС классически использовался для лечения малярии, метгемоглобинемии и отравления угарным газом, а также в качестве гистологического красителя.
Однако в последние годы его роль в митохондриях вызвала новый интерес. МС может перенаправлять электроны в митохондриальной цепи переноса электронов непосредственно с НАДН на цитохром с, повышая активность комплекса IV и эффективно стимулируя активность митохондрий при одновременном смягчении окислительного стресса. В дополнение к его благотворному влиянию на митохондриальную защиту, также известно, что MС оказывает сильное влияние на смягчение нейровоспаления. Митохондриальная дисфункция была идентифицирована как объединяющее патологическое явление для широкого спектра нейродегенеративных расстройств, что, таким образом, делает метиленовый синий перспективным терапевтическим средством.
В исследованиях как in vitro, так и in vivo MС продемонстрировал впечатляющую эффективность в смягчении нейродегенерации и сопутствующих поведенческих фенотипов на животных моделях при таких состояниях, как инсульт, глобальная церебральная ишемия, болезнь Альцгеймера, болезнь Паркинсона и черепно-мозговая травма.
В этом обзоре обобщается недавняя работа, устанавливающая, что MС является многообещающим кандидатом для нейропротекции, с особым акцентом на вклад митохондриальной функции в здоровье нервной системы.
Кроме того, в этом обзоре будет кратко рассмотрена связь между MС, нейрогенезом и улучшением когнитивных функций в отношении возрастного снижения когнитивных функций.
1. Введение
В современной фармакологии большое внимание уделяется перепрофилированию лекарств, использованию ранее одобренных лекарств в новых условиях. Перепрофилирование уже существующих лекарств экономит время и деньги и может привести к клиническому применению гораздо быстрее, чем новое терапевтическое средство, благодаря установленному опыту обширных испытаний на безопасность. Эта стратегия обязательна в областях исследований с высоким риском, таких как нейродегенеративные заболевания, где фармацевтические компании могут неохотно инвестировать большие суммы денег из-за разочаровывающего опыта клинических испытаний высокого уровня. Такие состояния, как инсульт, болезнь Альцгеймера (БА) и болезнь Паркинсона (БП), являются разрушительными и сопровождаются пожизненными последствиями, в результате чего у пациентов и их семей снижается продолжительность и качество жизни. Это влияние усугубляется отсутствием медицинских возможностей, которые могут замедлить или обратить вспять прогрессирование заболевания. Эти состояния остро нуждаются в новых методах лечения и потенциально могут значительно выиграть от финансовой и клинической привлекательности нового применения проверенного временем лекарства.
Метиленовый синий (МС) является одним из таких примеров многообещающего препарата с потенциалом для повторного использования. Впервые синтезированный в 1876 году в качестве красителя для текстиля, MС исследовали на предмет его медицинского применения еще в 1891 году [1]. МБ классически использовался в клинике в качестве сильнодействующего противомалярийного средства, средства для лечения метгемоглобинемии и в качестве медицинского окрашивающего средства [2]. Доказательства также показали, что MС эффективен в качестве профилактической терапии вазоплегического синдрома, возникающего после операции аортокоронарного шунтирования и септического шока в результате вазомодулирующего действия MС, которое основано на его ингибировании гуанилатциклазы (GC) и синтазы оксида азота. [3].
Хотя этиология и прогрессирование основных нейродегенеративных заболеваний сильно различаются, общим для всех является митохондриальная дисфункция. При нейродегенеративных состояниях, таких как инсульт, БА, БП или черепно-мозговая травма (ЧМТ), митохондриальная дисфункция и окислительный стресс являются ключом к прогрессирующему изнурительному характеру состояния [4]. Нарушение митохондриальной цепи переноса электронов из-за прямого повреждения или недостаточного оборота приводит к дефициту энергии и высвобождению активных форм кислорода, которые могут вызывать прямое и последующее повреждение и вредные эффекты [5]. Таким образом, нацеливание и улучшение здоровья митохондрий является главной целью новых методов лечения. Митохондриальный механизм MС, а также его установленные показатели безопасности делают его кандидатом на лечение этих разрушительных состояний.
В этом обзоре будут обсуждаться основные механизмы митохондриальной дисфункции при каждом из основных нейродегенеративных заболеваний, а также будут оцениваться недавние исследования, изучающие влияние MС на каждое из них. Будут выделены исследования, в которых основное внимание уделяется растущей роли MС как рециркулирующего антиоксиданта и альтернативного переносчика электронов в митохондриальной цепи переноса электронов в контексте нейродегенерации [5]. Когда это возможно, комбинированная терапия будет сравниваться с монотерапией. Мы также кратко рассмотрим доказательства, свидетельствующие о ноотропной роли MС.
2. История, механизмы и текущие показания метиленового синего
МС был первоначально синтезирован Хайнрихом Каро в качестве красителя для текстиля, но вскоре было обнаружено, что он находит широкое применение в области медицины [1]. Ранние новаторские исследования включали его использование в качестве медицинского красителя, за которым вскоре последовало его применение Эрлихом и Гуттманом для лечения малярии [6]. Этот эффект сделал его важным наркотиком во многих военных кампаниях, хотя побочный эффект синей мочи не был особенно хорошо воспринят. Хотя выделение мочи синего цвета было нежелательно для солдат, оно было очень полезно в психиатрии; включенный в состав лекарственного средства, MС обеспечивал видимый индикатор соблюдения режима лечения [1,7]. Такой показатель был неоценим при исторически жестком лечении психических больных на ранних препаратах, чреватых нежелательными побочными эффектами. Благодаря этому применению в психиатрии в конечном итоге было обнаружено, что сам по себе MС оказывает антипсихотическое действие, что привело к развитию трициклических препаратов. MС использовался в качестве пилотной молекулы, открывая новую эру психофармакологии [1,8]. Известно, что некоторые из этих эффектов связаны с его функцией мощного ингибитора моноаминоксидазы (ИМАО), но недавняя работа выявила роль митохондриальных механизмов и метаболических манипуляций как источника, по крайней мере, некоторых полезных психиатрических эффектов препарата [9 ,10]. В последние годы эта работа расширила психиатрическое применение MС для лечения резидуальной биполярной депрессии [11].
Эти результаты предполагают, что MС обладает биодоступностью для головного мозга, что подтверждается фармакокинеическими исследованиями. МБ лучше всего вводить внутривенно, в/в. введение обеспечивает более высокие концентрации в крови и AUC, чем пероральное введение, и имеет период полувыведения примерно 6,6 часов. Независимо от пути введения, MС накапливается в значительных концентрациях в различных тканях, при этом концентрация MС в тканях головного мозга в десять раз превышает уровень в сыворотке уже через 1 час после внутривенного введения. администрации. Поглощение тканями происходит быстро, значительное накопление в органах отмечается через 3 минуты в легких, печени, почках и сердце. Биодоступность также модулируется статусом окисления, поскольку стабилизированная версия восстановленной формы MС демонстрирует заметно повышенное поглощение мозгом, что было учтено в недавнем клиническом испытании, которое будет обсуждаться в следующем разделе.
В настоящее время основными медицинскими применениями MС являются метгемоглобинемия, вазоплегический синдром, хирургическое окрашивание и нейротоксичность ифосфамида. Метгемоглобинемия вызвана преобладанием метгемоглобина (met-Hb), формы гемоглобина (Hb), в которой железосодержащий центр гемовой группы окисляется до трехвалентного состояния. Это может быть унаследовано или вызвано воздействием токсинов окружающей среды или некоторыми наркотиками, такими как амилнитрит. Метгемоглобинемия проявляется усталостью, головными болями, головокружением и синеватой кожей и может привести к судорогам и смерти при отсутствии лечения. Как только MС восстанавливается до лейкометиленового синего (leucoMB) в эритроцитах, leucoMB может восстанавливать met-Hb до Hb, повторно окисляясь до MС. Наиболее ярко это проиллюстрировано в случае Блю Фугейтс, семьи из сельского Кентукки, известной синей кожей в результате наследственной метгемоглобинемии. Лечение быстро уменьшило синий оттенок их кожи, к их большому облегчению.
Хотя метгемоглобинемия является одним из наиболее распространенных применений MС, другие его применения неоценимы. В качестве клинического окрашивания MС дает поразительные результаты при обнаружении нервов и свищей и обычно используется в нескольких процедурах, а также при гистологическом окрашивании. MС также можно использовать в качестве дополнительной терапии для химиотерапии ифосамидом, распространенным химиотерапевтическим агентом с вредными неврологическими побочными эффектами из-за нарушения митохондриальной цепи переноса электронов (ETC). В качестве альтернативного переносчика электронов MС может способствовать функционированию митохондрий, ограничивая нейротоксические эффекты препарата [20]. Наконец, вазоплегический синдром представляет собой опасное для жизни состояние, возникающее после искусственного кровообращения и проявляющееся в виде значительного снижения артериального давления, особенно распространенного у пациентов с историей приема ингибиторов ангиотензинпревращающего фермента. Введение MС может помочь в этом состоянии путем ингибирования гуанилатциклазы и синтазы оксида азота, повышая артериальное давление. Благодаря этим важным и необходимым медицинским применениям MС признан Всемирной организацией здравоохранения одним из необходимых лекарств, необходимых в базовой системе здравоохранения.
В митохондриях MС играет замечательную роль благодаря своей способности каталитического окислительно-восстановительного цикла. MС получает электроны от NADH через комплекс I, превращая его в бесцветный восстановленный аналог лейкометиленового синего (leucoMB) (рис. 1). LeucoMB напрямую переносит эти электроны на цитохром с, повторно окисляясь в процессе до MС, готового начать цикл заново. Даже при ингибировании комплекса I с помощью ротенона MB может обходить блокировку ЭТЦ в комплексах I и III, способствуя дыханию (рис. 2). Окислительное повреждение, являющееся причиной и следствием митохондриальной дисфункции, повреждает в первую очередь комплекс IV, а также комплекс I. Эту блокировку также обходит MС, так как он может значительно повышать активность комплекса IV. Экспрессия субъединиц комплекса IV впоследствии повышается, возможно, за счет индукции ядерного респираторного фактора 1 (Nrf1), который, как было обнаружено, повышен у старых мышей, получавших MB. Это увеличение может быть связано с инактивацией PTEN за счет умеренного увеличения продукции H2O2 или ингибирования GSK-3, увеличивая экспрессию NRF1 ниже пути NRF2/ARE.

Рисунок 1
Химическая структура метиленового синего и лейкометиленового синего

Рисунок 2
Схема MB как альтернативного митохондриального переносчика электронов
Электроны в митохондриальной цепи переноса электронов передаются от комплекса I к комплексу IV, обеспечивая трансмембранный потенциал для производства АТФ комплексом V. Утечка электронов из комплекса I и комплекса III действует как основной клеточный источник продукции АФК. MB был продемонстрирован как альтернативный митохондриальный переносчик электронов для перенаправления электронов непосредственно от комплекса I к комплексу III, избегая утечки электронов и последующего образования АФК. Это значительно облегчает активность комплекса IV, усиливая митохондриальное дыхание.
Этот окислительно-восстановительный цикл может напрямую защищать от окислительного стресса при патологических состояниях, сопровождаясь усилением передачи сигналов ядерного фактора (эритроидного происхождения 2), подобного элементу 2/антиоксидантного ответа (Nrf2/ARE). В физиологических условиях MB также активирует Nrf2/ARE с соизмеримым увеличением антиоксидантной защиты в результате умеренного, полезного увеличения производства H2O2 [30]. Механизмы МБ в контексте конкретных условий будут подробно обсуждаться в следующих разделах.
3. Метиленовый синий, митохондриальная дисфункция и нейродегенерация
Мозг в значительной степени зависит от окислительного метаболизма как источника энергии, потребляя 20% глюкозы в организме и 20% кислорода в состоянии покоя [31]. Поддержание мембранного потенциала покоя, генерация потенциалов действия и постсинаптическое действие глутамата составляют основную часть этой потребности в энергии, которая тесно связана с активностью нейронов [32,33]. Учитывая поразительное отсутствие альтернативных источников энергии в мозге, правильное функционирование митохондрий необходимо для здоровья мозга. Дисфункциональные митохондрии, наоборот, вовлечены в несколько нейродегенеративных состояний, играя либо причинную, либо способствующую роль [4].
Основная функция митохондриальной ЭТЦ заключается в поэтапном переносе электронов высокой энергии от энергетических субстратов, полученных из пищи, таких как НАДН, к О2. Каждый шаг высвобождает энергию, которая используется для транспорта протонов через внутреннюю митохондриальную мембрану, создавая трансмембранный потенциал, который приводит в действие АТФ-синтазу, молекулярный ротор, который превращает АДФ в АТФ [23,34]. Правильная работа митохондрий зависит от последовательного прохождения электронов через каждую ступень ЭТЦ. Когда ETC становится максимально занятым, переносчики электронов начинают отдавать электроны O2, производя вредные АФК [34].
Радикалы супероксида, образующиеся в результате утечки электронов, сами по себе повреждают, но они могут реагировать с оксидом азота (NO), генерируемым синтазой оксида азота, с образованием высокореакционноспособного пероксинитрита (ONOO-). ONOO- может вызвать обширное повреждение клеточных липидных компонентов, что особенно влияет на чувствительные олигодендроциты и их предшественники [35,4]. Анионы супероксида могут быть преобразованы в H2O2 с помощью супероксиддисмутазы, но это также может быть преобразовано в более опасный продукт – гидроксильные радикалы [34]. После образования эти молекулы вызывают в значительной степени вредные модификации множества клеточных компонентов.
Белки часто становятся мишенью атаки свободных радикалов. Модификации белков с помощью ROS/RNS включают, но не ограничиваются: окислением, нитрозилированием, ацетилированием и фосфорилированием [36]. Поскольку митохондрии являются источником АФК и содержат несколько металлопротеинов, которые могут катализировать образование АФК, таких как гидроксильные радикалы, они сильно страдают от окислительного повреждения [34]. Митохондриальные компоненты ETC являются мишенями окислительного повреждения, что приводит к прогрессирующей метаболической деградации, способствующей нейродегенерации [37] (рис. 3).

Рисунок 3
МС в нейродегенерации
MС может защищать от апоптоза нейронов, подавляя митохондриальную дисфункцию и последующее окислительное повреждение и снижение уровня АТФ. MС поддерживает нейрогенез, уменьшая нейровоспаление и стимулируя рост нейритов и синаптогенез. Таким образом, MС может предотвратить повреждение нейронов и может способствовать восстановлению нейронов.
Функция митохондрий также зависит от динамики деления/слияния и митофагии, основные компоненты которой могут быть повреждены нитроксидативным повреждением [38]. Динамика деления/слияния регулируется ГТФазами семейства динаминов и служит для поддержания митохондриальной функции путем обмена митохондриальными компонентами и деградации поврежденных митохондрий посредством митофагии [4]. Окислительное повреждение родственного слиянию белка OPA1 приводит к перемещению в цитозоль с последующей фрагментацией митохондрий [39]. Фрагментация митохондрий распространена при некоторых нейродегенеративных заболеваниях, что будет более подробно обсуждаться в последующих разделах этого обзора [40]. Митохондриальный транспорт неразрывно связан с динамикой деления/слияния, и показано, что он нарушается при нейродегенеративных заболеваниях [4,41].
Все эти пагубные эффекты усугубляются повреждением мДНК, что приводит к повреждающим мутациям, гетерогенно распределенным среди митохондрий в одной клетке. Это повреждение препятствует надлежащему восстановлению митохондрий за счет упреждающего отключения белков до их трансляции. Это гарантирует, что повреждение митохондрий будет длительным и может даже распространяться во время событий деления/синтеза [42]. Эти мутации дополнительно усугубляются нарушением динамики деления/слияния и неправильной регуляцией митофагии [34]. Важно отметить, что все эти повреждения могут увековечивать друг друга по принципу прямой связи, приводя к прогрессирующей митохондриальной дисфункции, которая способствует неумолимому прогрессу нейродегенерации [38].
3.1 Метиленовый синий и ишемическое поражение головного мозга
Как отмечалось ранее, мозг чрезвычайно чувствителен к недостатку кислорода и глюкозы в результате его высоких энергетических потребностей [31]. Ишемия, или прекращение притока крови к мозгу, может быть очаговой или глобальной. Глобальная церебральная ишемия (GCI) представляет собой полную потерю мозгового кровотока (CBF) и возникает во время травмы, такой как остановка сердца, асфиксия, кардиохирургия и гипотензивный шок. Остановка сердца требует быстрого вмешательства; даже при реанимации это обычно смертельно, с летальностью более 90%. Тех, кто выживет, ждет множество возможных инвалидностей. Выжившие должны бороться с сенсомоторным дефицитом, нарушением регуляции настроения, потерей памяти и снижением когнитивных функций, которые являются результатом отсроченной гибели нейронов по всему мозгу, особенно в гиппокампе [74,75].
Единственным показанным в настоящее время вмешательством для предотвращения гибели клеток, вызванной GCI, является терапевтическая гипотермия (TH), которая замедляет окислительный метаболизм и потенциально смягчает вызванный реперфузией окислительный стресс и митохондриальный сбой [76,77] [78]. Ранняя индукция TH является обязательной, поскольку TH дает убывающую отдачу с увеличением продолжительности после GCI. Кроме того, для индукции ТГ требуется существенное специализированное оборудование и подготовка персонала для предотвращения значительных побочных эффектов [79]. Это ограничивает развертывание, требуя исследования альтернативных методов лечения, которые могут быть развернуты с большей легкостью и доступностью.
Очаговая церебральная ишемия, или инсульт, происходит почти каждые 40 секунд в Соединенных Штатах и убивает или значительно ухудшает состояние 60% пациентов. Инсульт влечет за собой тяжелые эмоциональные, медицинские и экономические потери, которые ежегодно обходятся в США почти в 33 миллиарда долларов [80]. Существует две основные категории инсульта: ишемический и геморрагический [80]. Большинство инсультов являются ишемическими, возникающими в результате закупорки церебральной артерии, обычно вследствие атеротромбоза [80]. Центральное ядро ишемизированной области быстро подвергается преимущественно некротической гибели клеток, в то время как окружающая область полутени подвергается прогрессирующей энергетической недостаточности, воспалению и отсроченной апоптотической гибели клеток [81].
В настоящее время существует только одно показанное вмешательство в терапии инсульта — тромболизис с использованием тканевого активатора плазминогена (tPA) [82–84]. Это обусловливает необходимость правильной диагностики с помощью методов визуализации головного мозга, которые поглощают 4-часовое временное окно, в течение которого можно спасти очаг инфаркта [83]. Поскольку инсульт часто не идентифицируется с этим временным окном, крайне необходимы фармакологические стратегии, которые могут свести к минимуму или предотвратить дегенерацию нейронов, особенно те, которые можно легко и дешево применить.
Церебральная ишемия, очаговая или глобальная, протекает с двумя фазами повреждения: ишемией и реперфузией. Во время начального начала ишемии энергетическая недостаточность сначала нарушает поддержание потенциала мембраны нейронов. Последующая деполяризация вызывает чрезмерное высвобождение глутаматергической кислоты, что вызывает быстрый приток Са2+. Резкое повышение уровня внутриклеточного Са2+ активирует фосфолипазы, кальпаины и катепсины, повышает активность ЦОГ-2 и NOS и вызывает прекращение синтеза белка [85,86]. Между тем, когда митохондриальное дыхание останавливается, утечка электронов генерирует АФК, которые повреждают митохондриальные и клеточные компоненты как нейронов, так и соседних клеток. Сосудистый эндотелий реагирует на это окислительное повреждение и локальное высвобождение воспалительных факторов путем проницаемости и нарушения целостности гематоэнцефалического барьера (ГЭБ) [87].
При реперфузии кислород и энергетические субстраты возвращаются в уже не функционирующие митохондрии. Дыхание возобновляется в дефектных митохондриях, высвобождая постоянно увеличивающиеся уровни АФК, что еще больше усугубляет окислительное повреждение. Пермеабилизация ГЭБ позволяет циркулирующим макрофагам инфильтрировать и поддерживать локальное воспаление [4]. Все это время микроглия и астроциты реагируют посредством глиальной активации, высвобождая во внеклеточную среду свои собственные воспалительные факторы [88]. Со временем этот самовоспроизводящийся цикл в конечном итоге проявляется в виде апоптотической гибели клеток в полутени при фокальной ишемии или в особенно чувствительных областях, таких как гиппокамп, при GCI [89]. Очевидно, что здоровье митохондрий является важным фактором дегенерации нейронов. Таким образом, митохондриальная дисфункция стала привлекательной мишенью для нейропротекции против ишемического инсульта.
Было показано, что MС оказывает нейропротекторное действие в нескольких моделях ишемического повреждения, отчасти благодаря его антиоксидантной способности и способности способствовать альтернативному переносу митохондрий. Тем не менее, большая часть работы в этой области была сосредоточена на ингибировании МС активности NOS. Большая часть этой работы была проделана на моделях остановки сердца у поросят в лаборатории Виклунда. В 2007 году они продемонстрировали, что введение MС в модели остановки сердца у поросят может значительно увеличить выживаемость в течение 5 часов, если их доставить через 1 минуту после реанимации. Интересно, что они отметили, что MС преодолевает гематоэнцефалический барьер, а позже обнаружили, что он может сохранять целостность ГЭБ [90,45]. Позже эта группа обнаружила, что лечение MС увеличивает системное кровообращение за счет ингибирования NOS и снижает показатели перекисного окисления липидов и воспаления. Эти защитные эффекты наблюдались как в мозговой, так и в сердечной ткани на модели свиньи [45]. Нейропротекторные эффекты MС значительно усиливались в сочетании с гипотермией как у свиней, так и у грызунов [46,47], возможно, из-за поддержания правильной функции митохондрий при замедлении метаболизма и индукции гипотермических клеточных ответов [91]. Возможно, что эффективность ТГ может быть повышена при добавлении промотора митохондриальной функции, особенно того, который может смягчить окислительное повреждение. Однако необходимы дополнительные доказательства, чтобы сделать убедительный вывод о перспективах комбинированной терапии МС+ТГ.
Исследования клеточных культур из других лабораторий показали, что некоторые нейропротекторные эффекты MС связаны со стабилизацией Hif-1α и фосфорилированием пути Akt [44]. Некоторые эффекты могут быть связаны с ингибированием каспаз. MС также может окислять функциональный остаток цистеина как на каспазе-3, так и на каспазе-6, предотвращая их протеолитическое действие [48]. Этот феномен также может лежать в основе нейропротекции МС и требует дальнейшего изучения.
Те же самые митохондриальные нейрозащитные механизмы MС, продемонстрированные в GCI, также продемонстрировали эффективность на нескольких животных моделях инсульта. MС может увеличить церебральный кровоток в гипоперфузированной ткани в постоянной модели MCAO у крыс, блокируя сосудорасширяющее действие NO посредством ингибирования GC и NO-синтазы, предотвращая эскалацию развития полутени [52,49]. Лежащий в основе митохондриальный механизм MС был подтвержден на моделях инсульта с повышенным поглощением O2, комплексной активностью IV и содержанием АТФ [54,50,51]. Другая работа неоднократно показывала, что размер инфаркта можно контролировать или уменьшить с помощью MС, и что эта защита соизмерима с улучшенными поведенческими результатами в моделях грызунов [44,53]. Механизмы, с помощью которых это достигается, разнообразны.
В вышеупомянутом исследовании было показано, что MС удалось восстановить митохондриальную структуру и потенциал митохондриальной мембраны при сохранении митофагии [51]. Подобные исследования связывают индукцию аутофагии MС с активацией mTOR и фосфорилированием AKT [44,92]. Примечательно, что недавняя работа по применению MС при субарахноидальном кровоизлиянии, форме геморрагического инсульта, заметно недостаточно представленной в исследованиях MС, показала аналогичное увеличение фосфорилирования AKT и GSK-3β, которое сопровождалось улучшением неврологической функции и уменьшением нейровоспаления [55]. Повсеместно было обнаружено, что MС ингибирует проапоптотические пути и обеспечивает нейрозащиту от гибели клеток в области полутени, в некоторых случаях сохраняя критические клеточные структуры, такие как концевые ножки астроцитов [93,50].
Как упоминалось ранее, работа в нашей лаборатории показала, что MС может способствовать нейропротекции за счет снижения активации каспазы и защиты потенциала митохондриальной мембраны. Результаты также коррелировали с улучшенными поведенческими характеристиками в лабиринте Барнса, классическом тесте пространственной памяти, зависящей от гиппокампа [43]. В нашей дальнейшей работе лечение МБ применялось к модели фототромботического инсульта у крыс. Мы продемонстрировали нейрозащиту от гибели нейронов, а также стимулирование нейрогенеза, вызванного инсультом. Эти результаты были параллельны уменьшению воспаления в микросреде [54]. Мы предполагаем, что это результат роли митохондрий в нейрогенезе, которая будет обсуждаться более подробно в следующем разделе.
Комбинированная терапия изучается с большим интересом, несмотря на присущую ей сложность дизайна исследования. Новый пример комбинированного лечения нормобарической гипероксии с MС. Комбинированная терапия уменьшила объем инфаркта и привела к поведенческим улучшениям в модели инсульта по сравнению с любым лечением по отдельности [56]. Наша работа показала, что добавление MС к терапевтической гипотермии помогло спасти гибель нейронов и поведенческие результаты после расширенного GCI. Более того, комбинированная терапия значительно снижала активацию глии, воспаление и пути апоптоза каспазы-3. Это было связано с улучшением митохондриальной дисфункции. Все эти эффекты заметно усиливались при комбинированной терапии по сравнению с любой монотерапией [46]. Поэтому вполне вероятно, что комбинированная терапия является ключом к максимизации полезных эффектов MС, особенно с учетом широкого диапазона и разнообразия ишемического повреждения головного мозга, в частности инсульта. Если MС действительно окажется успешным в лечении ишемического повреждения головного мозга, локального или глобального, он может открыть эффективное лечение в различных медицинских учреждениях из-за его повсеместного распространения во всем мире.
3.2 Метиленовый синий и болезнь Альцгеймера
БА представляет собой прогрессирующее нейродегенеративное заболевание, поражающее 1 из 9 человек старше 65 лет и приводящее к потере памяти, снижению когнитивных функций, тяжелой инвалидности и смерти [70]. В настоящее время не существует эффективного лечения БА, которое могло бы остановить или значительно замедлить неумолимое ухудшение состояния пациента. В этом отношении это делает БА уникальным среди основных убийц в США, поскольку это одна из немногих основных причин смерти с небольшими профилактическими или терапевтическими мерами [70]. Учитывая рост сообщества пожилых людей в результате более качественного и доступного здравоохранения, важность терапевтических возможностей для лечения болезни Альцгеймера со временем будет только возрастать. Крайне важно разработать лекарства, которые могут воздействовать на ключевые механизмы или несколько механизмов в случае MС.
АтД классически характеризуется гистологически накоплением сенильных бляшек, олигомеров β-амилоида (Aβ) и нейрофибриллярных клубков (NFT), состоящих из гиперфосфорилированного тау-белка [70]. Aβ является продуктом протеолитического расщепления мембраносвязанного белка-предшественника амилоида (APP) последовательно γ-секретазой и β-секретазой. Процессинг АРР Aβ может происходить по одному из двух путей: амилоидогенному и неамилоидогенному пути [94]. Неамилоидогенный путь начинается с расщепления АРР α-секретазой, что дает растворимый N-концевой фрагмент, sAPP-α, и связанный с мембраной С-концевой фрагмент (CTF-α). CTF-α далее процессируется γ-секретазой с образованием другого N-концевого растворимого фрагмента, p3. Растворимые фрагменты, генерируемые этой последовательностью, не образуют агрегатов и не являются нейротоксичными. Однако амилоидогенный путь начинается с расщепления АРР β-секретазой с образованием sAPP-β. Расщепление γ-секретазой оставшегося фрагмента CTF-β генерирует Aβ, который постепенно агрегирует из олигомеров в бляшки, которые накапливаются внеклеточно, нарушая клеточную функцию и активируя воспалительные пути [94]. Олигомерный Аβ также накапливается внутриклеточно, локализуясь в митохондриях, способствуя митохондриальной дисфункции и энергетической недостаточности, характерным для патологии БА [95].
Классически основной подход к терапевтическим исследованиям при БА был нацелен на Aβ. МС совсем недавно, в 2007 году, начали изучать в этом качестве. Ранние работы показали, что MС может способствовать фибрилляции Aβ, тем самым подавляя образование нейротоксического олигомерного Aβ, хотя более поздние исследования in vitro были противоречивыми [96,67]. Работа, проведенная на трансгенных мышах (3xTg-AD), показала, что MС поддерживает протеолитический клиренс Aβ за счет повышения активности химотрипсина и трипсиноподобной протеасомы в головном мозге [64]. Уменьшенное отложение Aβ в гиппокампе и соседней коре головного мозга наблюдалось в другой модели трансгенных мышей (APP/PS1), и эти наблюдения были подтверждены соразмерной защитой от снижения когнитивных функций в поведенческих задачах, измеряющих социальное взаимодействие, обучение и память, а также исследовательскую активность [61]. Аналогичные результаты были получены на трансгенных мышах PSAPP, у которых было установлено, что антиамилоидогенный механизм связан с ослаблением активности и экспрессии β-секретазы [60].
Митохондриальная дисфункция на ранних стадиях патологии БА проявляется до значительного отложения бляшек и снижения когнитивных функций [97–99]. Активность дыхательной цепи затруднена, особенно в комплексах III и IV, что приводит к снижению энергетического метаболизма в пораженных участках [98, 100, 101]. Известно, что растворимый Aβ колокализуется в митохондриях и импортируется митохондриальным комплексом импорта, TIM/TOM [102,103]. Оказавшись в митохондриях, Aβ действует на несколько молекулярных мишеней, включая Aβ-связывающую алкогольдегидрогеназу (ABAD) и комплекс IV, вызывая повреждение ETC и последующую выработку АФК, что приводит к нарушению потенциала митохондриальной мембраны [104, 63, 105, 103].
Помимо повреждения клеточных компонентов, Аβ-индуцированная генерация АФК также служит для индукции митохондриальной фрагментации в результате s-нитрозилирования Drp1 [106]. Это изменение в митохондриальной динамике сопровождается снижением аксонального митохондриального транспорта [104]. Aβ также приводит к повышению уровня митохондриального Ca2+, что может индуцировать открытие mPTP, высвобождение цитохрома с и фактора, индуцирующего апоптоз (AIF), которые запускают индукцию путей гибели клеток [97] . Эти особенности указывают на поразительное клиническое значение митохондриальной недостаточности при БА, а также на потенциальную мишень для терапевтических средств, таких как MС.
Хорошо известно, что MB способствует активности комплекса IV и митохондриальной активности, и этот эффект распространяется на мозг AD [107,26]. Одним из основных механизмов MС является стимулирование активности комплекса IV посредством циклирования электронов, но способствующим фактором является активация синтеза гема [63,107]. В крысиной модели AD со стрептозотоцином (STZ) увеличение продукции комплекса IV и АТФ отражалось в улучшении когнитивного дефицита, вызванного повреждением гиппокампа [57]. Было показано, что MС снижает маркеры окислительного стресса в нескольких моделях AD с помощью методов электронного циклирования и ингибирования нижестоящих механизмов и взаимодействий [57, 108, 109].
Одним из таких методов является ингибирование связывания Aβ-ABAD, предотвращающее связанный с этим выход АФК, отказ MMP и последующую гибель клеток [109–111,103]. Стимулирование митохондриальной функции может предотвратить цитозольное высвобождение факторов, вызывающих смерть, но MС может сделать эту защитную меру еще на один шаг, дезактивируя каспазы посредством окисления функционального цистеина. MС также нацелен на другие признаки расстройства, NFT и Aβ-бляшки. Принимая во внимание прогрессивную обратную связь почти каждого аспекта механизмов БА, эти более широкие механизмы смягчают дальнейшие митохондриальные нарушения.
Другой важной особенностью БА является наличие NFT, агрегатов гиперфосфорилированного тау-белка (р-тау). Тау представляет собой белок, ассоциированный с микротрубочками, который широко распространен в ЦНС, стабилизируя микротрубочки нейронов. Тау является мишенью фосфорилирования для киназ, таких как киназа гликогенсинтазы 3β (GSK3β), киназа c-Jun (JNK) и циклинзависимая киназа 5 (cdk5) [112–114]. В то время как фосфорилирование тау является физиологическим процессом, чрезмерное фосфорилирование тау является патологическим и способствует деградации нейронов при БА.
При чрезмерном фосфорилировании тау диссоциирует от микротрубочек, вызывая их дестабилизацию и последующее растворение. При этом сам p-tau агрегирует в клубки [115]. При нарушении сетей микротрубочек нарушается клеточная функция и аксональный транспорт, например, вышеупомянутый дефицит митохондриального транспорта [116]. Клиренс через протеасомы также затруднен. Хотя p-tau сильно убиквитинилирован, p-tau продолжает накапливаться в избытке, который может очистить протеасома [117,116]. Горячо обсуждается вопрос о том, предшествует ли таупатия патологии Aβ или является ее следствием, как и ее точный вклад в патологию. Несмотря на это, ясно, что агрегация тау играет жизненно важную роль при БА, и устранение ее дисфункции является важной темой изучения.
Пионерская работа по применению MС при БА была проведена Клодом Вишиком, в ходе которого его лаборатория обнаружила, что MС обращает вспять агрегацию тау, блокируя связывание тау-тау, хотя и в дозах, превышающих клинически значимые уровни [66]. MС и его производные уменьшали накопление тау-филаментов в анализе in vitro, что, как позже выяснилось, было связано с ингибированием образования филаментов на первом и четвертом повторяющихся пептидах в домене, связывающем тау-микротрубочки [68,118]. В отличие от других родственных красителей, MС не связывается и не ассоциируется с протофибриллами тау [119]. Он предотвращает фибрилляцию, окисляя остатки цистеина в тау, заставляя их образовывать более стабильную мономерную форму, устойчивую к агрегации [69].
Кроме того, также было замечено, что MС способствует удалению тау-филаментов, индуцируя аутофагию [65]. Многочисленные исследования показали, что MС помог снизить нагрузку тау в различных моделях трансгенных мышей с таупатией при краткосрочном и долгосрочном лечении, и что этот клиренс был связан с улучшением когнитивного дефицита [58,62]. При превентивной доставке MС может предотвратить снижение когнитивных функций и накопление тау у трансгенных мышей, экспрессирующих проагрегантный человеческий тау [120].
Исследования с применением МС на различных моделях животных дали интересные, хотя и несколько противоречивые результаты. MС не удалось снизить нагрузку тау в модели рыбок данио, хотя он показал многообещающие результаты в снижении агрегации гентингтина [121]. В модели трансгенной тауопатии C. elegans MB удаляли тау и способствовали правильному митохондриальному транспорту, который сопровождался повышенной подвижностью [122].
MС применялся в клинических испытаниях на людях, начиная с фазы 2 клинических испытаний MС под названием «Rember». Исследование показало улучшение как когнитивных функций, так и мозгового кровотока у пациентов с БА легкой и средней степени тяжести [59]. Был разработан вариант молекулы лейкометилтиониния бис (гидрометансульфонат), или LMTM, более стабильный в восстановленной форме [15]. К сожалению, последующее 15-месячное исследование фазы 3 LMTM дало отрицательные результаты [14]. Ожидается еще одно исследование LMTM в легких случаях БА. Эти и другие исследования могут дополнительно пролить свет на защитные механизмы МС против БА и могут однажды привести к клиническому воплощению.
3.3 Метиленовый синий и болезнь Паркинсона
Болезнь Паркинсона (БП) представляет собой прогрессирующее нейродегенеративное заболевание, возникающее в результате гибели дофаминергических нейронов в черной субстанции (ЧС), клинически проявляющееся тремором, ригидностью, нарушением движений, плоским лицом и депрессией [4]. Заболевание обычно возникает после 50 лет, поражая 100–300 человек из каждых 100 000, проявляя двигательные симптомы у большинства пациентов [123]. БП снижает ожидаемую продолжительность жизни пациентов, при этом возраст начала значительно влияет на прогноз; у пациентов с ранним началом ожидаемая продолжительность жизни снижается на 10 лет, а у пациентов с поздним началом — около 5 лет ожидаемой продолжительности жизни [124]. Смертность при БП обычно является результатом падений или респираторных инфекций и отеков, часто возникающих в результате случайной аспирации пищи из-за затрудненного глотания [125–127].
Лечение болезни Паркинсона обычно заключается во введении предшественника дофамина леводопы, которая уменьшает ригидность и тремор. К сожалению, терапия леводопой сопровождается неврологическими и поведенческими побочными эффектами, и в ходе лечения обычно требуются постоянно увеличивающиеся дозы и вторичные препараты [128]. Левадопа, хотя и жизненно необходима пациентам, является паллиативным средством и не замедляет прогрессирование заболевания. Таким образом, крайне важно разработать методы лечения, которые могут воздействовать на ключевые механизмы повреждения нейронов, чтобы остановить или обратить вспять течение болезни.
Гистологическим признаком болезни Паркинсона является наличие телец Леви и нейритов Леви, внутриклеточных агрегатов белка α-синуклеина (α-син) [4]. Эти агрегаты в значительной степени связаны с изменениями экспрессии убиквитинлигазы E3, Parkin, которая вызывает дефицит контроля качества митохондрий, препятствуя переносу микротрубочек [129]. A-syn при перемещении в митохондрии может нарушать функцию как комплекса I, так и комплекса IV ETC, что приводит к прогрессирующей митохондриальной дисфункции, которая усиливается недостаточностью митофагии [130,131]. Эта дисфункция ETC является основой, на которой генерируются две из наиболее широко используемых моделей симптомов БП: MPTP и ротенон, оба из которых ингибируют комплекс I [5, 132]. Эти токсины вызывают характерное повреждение дофаминергических нейронов ЧС и проявляют паркинсонический тремор [132]. Как и при всех нейродегенеративных заболеваниях с митохондриальным механизмом, терапевтические стратегии, нацеленные на такую дисфункцию, предлагают заманчивое направление исследований.
Основополагающая работа, которая определила альтернативную способность переноса электронов MС, была обнаружена с использованием ротеноновой модели PD. Наряду с упомянутым выше сохранением функции ЭТЦ лечение МС сопровождалось поведенческими улучшениями в треморе, локомоции, осанке и двигательных навыках [5]. Помимо этого исследования, доказательства эффективности при БП являются косвенными, но все же многообещающими. Как митофагия, так и общая аутофагия индуцируются введением MС, что может смягчить дефицит контроля качества митохондрий, который приводит к прогрессированию заболевания [51,65]. Более того, установленные антиоксидантные и стимулирующие ETC функции MС в митохондриях нацелены на те самые комплексы, на которые больше всего нацелена PD [27,5,133].
С его низким профилем побочных эффектов существует вероятность того, что MС, вводимый профилактически или на ранних стадиях болезни Паркинсона, может предотвратить прогрессирование расстройства из-за полезных эффектов низких уровней H2O2, генерируемых MС в физиологических условиях, опосредованных Путь Nrf2/ARE, который предположительно связан с болезнью Паркинсона [134, 135, 30]. Наконец, свойства MС, связанные с ИМАО, могут обеспечить дополнительные преимущества при постоянном приеме леводопы, хотя профиль безопасности этой комбинации требует тщательного изучения [136, 128]. Тесная связь профиля митохондриальных эффектов MС и митопатии, присутствующей при БП, кажется многообещающей, подчеркивая необходимость применения MС к различным химическим и генетическим моделям животных при БП.
3.4 Метиленовый синий при черепно-мозговой травме
В последние годы TBI вновь привлек внимание общественности из-за того, что спортивные травмы и солдаты, возвращающиеся из зон активных боевых действий по всему миру, стали заметными. Черепно-мозговая травма является серьезной причиной смерти и инвалидности, ежегодно регистрируя около 2 миллионов случаев в Соединенных Штатах [137]. ЧМТ является результатом сильной травмы головы, хотя это простое объяснение противоречит неоднородному характеру состояния. Травма ЧМТ состоит из двух фаз: первичной и вторичной. Первичным повреждением является само механическое повреждение, которое вызывает смещение аксональных путей, разрыв микроциркуляторного русла и сдавление мозговой ткани. Со временем развивается вторичное повреждение, включающее повышение внутричерепного давления, отек головного мозга, эксайтотоксичность, прогрессирующее воспаление, активацию глии, метаболическую недостаточность, судороги и ишемическое повреждение [138,139]. Нарушения, вызванные ЧМТ, различаются в зависимости от силы удара; тяжелые случаи могут сопровождаться потерей сознания, долговременной потерей памяти и судорогами, в то время как «легкая» ЧМТ может проявляться спутанностью сознания, дефицитом внимания или когнитивных функций, а также нарушением сохранения памяти, хотя определение легкой ЧМТ несколько размыто [138, 140].
Большая часть клеточной патологии при ЧМТ имеет поразительное сходство с ишемическим повреждением головного мозга, и на то есть веские причины. Повышенное внутричерепное давление, нарушение регуляции мозгового кровообращения и нарушение микроциркуляторного русла служат для ограничения кровотока и последующей доставки кислорода в мозг, что приводит к энергетической недостаточности, эксайтотоксичности и митохондриальной дисфункции [141, 142]. Перепроизводство АФК приводит к прогрессирующему упадку митохондрий и хронической глиальной активации, способствуя возникновению известного паттерна митохондриальной нейродегенерации [143,144]. Механическое разрушение путей белого вещества усугубляет повреждение, нарушая аксональный митохондриальный транспорт. Дисфункциональные митохондрии после аксотомии выделяют избыточное количество АФК рядом с чувствительными, богатыми липидами олигодендроцитами, вызывая значительное перекисное окисление липидов и дальнейшее прогрессирование глиоза [145]. АФК и региональное воспаление вызывают пермеабилизацию ГЭБ за счет активации металлопротеиназ матрикса и снижения экспрессии белков плотных контактов. Это обеспечивает обратную связь и способствует воспалению и инфильтрации периферических макрофагов, снова усиливая экспрессию и высвобождение воспалительных факторов и воспалительных сигналов [146].
Эти процессы приводят к активации конкурирующих путей клеточной гибели, генерирующих фенотипы гибели в континууме от апоптоза до некроза [147]. Ориентация на эти пути оказалась сложной задачей. Терапевтическая гипотермия применялась так же, как и при GCI. В случае ЧМТ он эффективен для снижения внутричерепного давления, но применяются те же ограничения в технике и доступности [148]. Гипербарическая оксигенотерапия также изучалась с ограниченной эффективностью [149]. Значительное исследование было посвящено антиоксидантной терапии при ЧМТ, что дало многообещающие доклинические результаты. Эти результаты, к сожалению, не нашли подтверждения в клинических испытаниях [150]. Возможно, что многие неудачи лечения ЧМТ, а также других нейродегенеративных состояний связаны с дизайном доклинических исследований или различиями между видами. Особенно при инсульте и ЧМТ основным фактором может быть неоднородность травмы. Несмотря на это, окно для эффективных методов лечения широко открыто, и пациенты отчаянно нуждаются в нем.
В нескольких доклинических исследованиях изучалась терапия MС после легкой ЧМТ, но настоящие исследования обнадеживают. Первоначальные исследования показали, что MС, вводимый дважды вскоре после ЧМТ, может уменьшить объем инфаркта в течение нескольких временных точек, вплоть до 14 дней после ЧМТ. МС уменьшал соматосенсорный дефицит в поведенческих тестах и уменьшал гибель клеток в пораженной коре [72]. Это было подтверждено работой, показывающей, что лечение MС, проводимое в течение 15–30 минут после ЧМТ, может уменьшить отек головного мозга и воспаление в долгосрочной перспективе после ЧМТ. Неврологическая оценка улучшилась при MС, но никаких различий не было замечено в конкретных тестах на координацию движений [73]. Эти результаты обнадеживают, но стратегия дозирования нереалистична; крайне маловероятно, что у пациента с ЧМТ будет возможность провести почти немедленную инфузию MС.
К счастью, другие исследования показали, что лечение даже через 24 часа после ЧМТ может воспроизвести аналогичные улучшения размера инфаркта и неврологической функции [71]. Эти результаты были отражены и расширены в последующем исследовании с парадигмой множественного лечения, в которой лечение МС уменьшало отек, долгосрочный глиоз, гибель нейронов и размер инфаркта, защищая при этом от поведенческих нарушений. Более того, эти преимущества были связаны с усилением индукции аутофагии [70].
Эти и другие исследования, касающиеся ишемического повреждения, воодушевляют, поскольку пациенты с ЧМТ остро нуждаются в эффективных методах лечения, особенно таких недорогих и доступных, как MС. Однако из-за разнообразной природы черепно-мозговых травм маловероятно, что один агент обеспечит наиболее оптимальную защиту от совокупности патологий после ЧМТ. Таким образом, MС, вероятно, окажется наиболее эффективным в форме комбинированной терапии, как описано ранее в контексте GCI и инсульта. В настоящее время таких исследований не проводилось, но растущая литература по комбинированной терапии МС при других повреждениях головного мозга может стать прочной основой для разработки исследований, применимых к ЧМТ. Хотя эти исследования по своей сути будут сложными, перспектива эффективного лечения повреждения нейронов, вызванного ЧМТ, слишком важна, чтобы ее игнорировать.
4. Метиленовый синий в улучшении когнитивных функций, возрастном снижении когнитивных функций и нейрогенезе.
Когнитивное улучшение с помощью фармацевтических препаратов — это идея, которая давно привлекает внимание и воображение общественности. Эта концепция широко распространена в общественном сознании, и целые интернет-сообщества сосредоточены на концепции и исследовании потенциальных усилителей когнитивных функций, или ноотропов. Предлагаемые усилители когнитивных функций варьируются от добавок аминокислот до традиционно используемых травяных добавок [151, 152]. С этой целью часто злоупотребляют клинически назначенными стимуляторами, особенно в кампусах колледжей, что усиливает общественную стигматизацию законных пациентов и достоверность диагнозов синдрома дефицита внимания и гиперактивности в целом [153]. Очевидно, что расширение познания представляет значительный интерес как для общественности, так и для исследователей. Улучшение познания может оказаться в пользу общественного блага с точки зрения производительности и качества жизни, особенно в отношении пожилого населения. В свете этого дешевые доступные соединения, которые могли бы безопасно поддерживать или улучшать когнитивные функции, являются идеальными кандидатами. Поэтому MС в этом отношении является многообещающим соперником.
В последние годы все чаще исследуется концепция улучшения когнитивных функций посредством митохондриальной модуляции. Общая концепция заключается в том, что за счет улучшения митохондриальной функции и окислительной защиты нейроны могут функционировать с повышенной эффективностью и поддерживать надлежащее здоровье, улучшая базальную функцию и препятствуя снижению когнитивных функций, связанному с возрастом и нейродегенерацией [154]. Ранняя работа Gonzalez-Lima показала, что MС улучшает сохранение пространственной памяти наряду с длительной митохондриальной дыхательной функцией, опосредованной через комплекс IV [26]. Длительная активация CCO может быть связана с увеличением продукции H2O2 без образования супероксида через MС в физиологических условиях, что приводит к активизации Nrf2/ARE [135]. В исследовании на людях введение MС увеличивало цереброваскулярную реактивность в задаче на психомоторную бдительность и в тесте на кратковременную память. Это сопровождалось умеренными улучшениями в тесте кратковременной памяти [155]. Эти преимущества, коррелирующие с функцией митохондрий, подтверждаются экспериментами, показывающими аналогичное улучшение когнитивных функций при фотобиомодуляции, стимуляции комплекса IV транскраниальным лазерным излучением ближнего инфракрасного диапазона [156].
Метаболические расстройства хорошо зарекомендовали себя в головном мозге пожилых людей, особенно в областях, классически связанных с высшими функциями мозга [157–159]. Митохондриальные повреждения со временем накапливаются и постепенно способствуют угасанию нейронов с возрастом, как и при нейродегенеративных состояниях [158]. Эти митохондриальные нарушения включают в себя нарушение цепи переноса электронов, недостаточность митофагии и сдвиг в сторону чрезмерного деления, мутации мтДНК и чрезмерное производство АФК [158]. Эти особенности связаны с когнитивным дефицитом у пожилых людей, так же как и у людей с БА, НКИ, большим депрессивным расстройством и другими состояниями. Таким образом, защита здоровья митохондрий может обеспечить некоторую степень защиты от слабоумия или других форм возрастного когнитивного дефицита. MС, как подробно описано ранее, может блокировать или предотвращать многие из этих митохондриальных повреждений и, таким образом, может иметь потенциал для защиты когнитивных функций от разрушительного метаболизма с возрастом. Эта возможность до сих пор формально не исследовалась и остается открытым вопросом и областью научных исследований.
Хорошо известно, что нейрогенез происходит во взрослом возрасте как физиологический процесс и как ответ на травму [160]. После развития нейрогенез ограничивается тремя областями мозга: обонятельной луковицей, кортикальной субвентрикулярной зоной (СВЗ) и субгранулярной зоной (СГЗ) зубчатой извилины гиппокампа (ЗГ). Нарушение этого процесса связано с нарушением консолидации памяти и регуляции настроения и вовлечено в нейродегенерацию и возрастное снижение когнитивных функций, поскольку нейрогенез и связанные с ним процессы резко снижаются в пожилом возрасте [161]. Таким образом, стимуляция и поддержание нейрогенеза является заманчивой целью для возрастной деменции, учитывая существенные общие черты с другими патологическими формами нейродегенерации.
Нейрогенез также одновременно стимулируется и тормозится в условиях, протекающих после повреждения головного мозга [162]. В животных моделях инсульта нейрогенез стимулируется как в SVZ, так и в SGZ наряду с высвобождением эритропоэтина и как сосудистых, так и эпидермальных эпителиальных факторов роста, которые индуцируют пролиферацию клеток-предшественников нейронов (NPC) [162–164]. Новообразованные нейроны мигрируют в поврежденную область и пытаются функционально встроиться в существующую нейронную сеть, чтобы облегчить восстановление [165]. Восстановление нервной системы путем стимуляции нейрогенеза привлекательно, но ограничено реакцией микросреды на травму. Хроническое нейровоспаление и активация глии, обе особенности, связанные с преклонным возрастом [166], являются общими для большинства нейродегенеративных состояний, и оба эти фактора тормозят нейрогенез [166] [160, 167–171]. Этот дефицит нейрогенеза можно смягчить противовоспалительным лечением [172]. АФК, генерируемые реактивной глией, также повреждают и истощают пулы NPC [173]. Добавление антиоксиданта, как и противовоспалительная блокада, предотвращало истощение новообразованных нейронов [174]. Кроме того, целостность митохондрий имеет решающее значение для нейрогенеза и, таким образом, активируется во время пролиферации и дифференцировки [175]. Дефицит митохондрий, в основном проявляющийся в экспериментах с цибридами, демонстрирует заметные нарушения как пролиферации, так и дифференцировки [176-178].
Несколько исследований применяли MС к нейрогенезу, но те, которые применялись, а также общие действия MС предполагают потенциал для полезных эффектов. Ранее упомянутое исследование GCI с применением MС к модели поросят показало, что MС активировал гены, связанные с нейрогенезом, включая синаптогенез, рост нейритов и факторы выживания [91]. MС подавлял пролиферацию крысиных NPC, подавляя экспрессию циклина и активность mTOR. Это кажется противоречивым, но чрезмерная пролиферация истощает пул NPC, уменьшая будущую способность к нейрогенезу. МС также не влиял на дифференцировку нейронов. Эти результаты, однако, наблюдались у крыс первого дня жизни после рождения, поэтому неясно, применим ли этот защитный механизм к поврежденному мозгу взрослых особей [179]. Работа в нашей лаборатории показала, что MС, доставляемый после фототромботического инсульта, способствует нейрогенезу. Кроме того, он подавлял воспаление, глиоз и улучшал функцию митохондрий — все это способствует нейрогенному дефициту. Это наводит нас на мысль, что MС, возможно, могут способствовать или поддерживать нейрогенез после травмы, делая местное микроокружение более податливым для новообразованных нейронов, поддерживая при этом их митохондриальную эффективность [54]. В то время как поддержание выживания вновь образованных нейронов равносильно, поддержка их миграции также необходима для поддержания восстановления нейронов. Опять же, доказательства ограничены, но недавние данные указывают на то, что MС может модулировать миграцию взрослых нервных стволовых клеток мыши в анализе миграции клеток [180]. Необходимо гораздо больше доказательств, чтобы сделать убедительный вывод о влиянии и роли MB в стимуляции нейрогенеза у взрослых и митохондриального здоровья в пожилом возрасте. В случае подтверждения МБ может служить многогранным инструментом для сохранения когнитивных функций и качества жизни пожилого населения, что является жизненно важным демографическим фактором в стареющем обществе.
6. Побочные эффекты и противопоказания метиленового синего
МС явно перспективен в качестве терапевтического средства для лечения многих состояний, но, как и любое лекарство, он имеет ряд ограничений. Вазомодулирующие свойства MС полезны в терапевтических дозах, но сопряжены с риском при более высоких концентрациях. Эти риски варьируются от повышения артериального давления и сосудистого сопротивления до нарушений сердечной функции и ритма [2]. Точно так же MС может влиять на измерения пульсоксиметрии, препятствуя правильной диагностике.
Другим токсическим эффектом является индукция анемии у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы. Новорожденные также подвержены анемии и многим другим побочным эффектам в ответ на MС [2]. У новорожденных МС может вызывать гипербилирубинемию, проявляющуюся желтухой [181]. Это довольно прискорбно, так как общепринятым методом лечения гипербилирубинемии является фототерапия, которая активирует фотодинамическую активность МС. Это генерирует возбужденные формы кислорода, которые вызывают значительное повреждение эпидермиса [182]. Таким образом, при любом применении MС следует относиться с осторожностью к любому другому фотосенсибилизатору. У новорожденных лечение MС также может, как это ни парадоксально, привести к метгемоглобинемии [183].
Последний и наиболее клинически значимый побочный эффект у взрослых пациентов связан с использованием обычных психиатрических препаратов, селективных ингибиторов обратного захвата серотонина (СИОЗС). MС является сильнодействующим ИМАО, который в сочетании с СИОЗС может потенцировать серотониновый синдром, опасный для жизни неотложной медицинской помощи [184–186]. Учитывая повсеместное распространение пациентов, принимающих СИОЗС, целесообразно проводить скрининг пациентов на наличие этих препаратов перед введением MС. Несмотря на это, риски МС относительно низки и достаточно предсказуемы, что является хорошим предзнаменованием для адаптации в клинике.
7. Выводы
Нейродегенеративные расстройства представляют собой серьезную проблему в медицине, требующую больших потерь, как человеческих, так и финансовых. Относительная нехватка терапевтических вариантов по своей сути обескураживает, но именно эта вакансия должна стимулировать инновации. Борьба этих пациентов мотивирует преданных своему делу исследователей, а неиспользованный характер этого рынка должен побуждать инвесторов поддерживать эти усилия. Хотя эти амбиции могут быть омрачены менее чем звездным послужным списком, есть надежда на предприятия с меньшим риском в виде перепрофилированных фармацевтических препаратов, таких как MС. Отличные показатели безопасности MС хорошо зарекомендовали себя за столетие медицинского использования. Его недавно изученная роль в качестве митохондриального энхансера и рециркуляционного антиоксиданта является ключом к его потенциалу в качестве терапевтического агента. С обнадеживающими результатами доклинических испытаний некоторых из наиболее инвалидизирующих нейродегенеративных состояний, МС следует исследовать с новым энтузиазмом в ближайшие годы. Если эти результаты будут подтверждены в будущих исследованиях на людях, MС может оказаться универсальным средством, способным улучшить здоровье пациентов, страдающих от бремени нейродегенеративных заболеваний и травм головного мозга, давая им и их близким облегчение и лучшее качество жизни.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.evdokimenko.ru/mc/
Метиленовый синий при коронавирусе: неожиданная информация
Автор: EVDOKIMENKO · 29.01.2021
Недавно у нас вышло видео, в котором мы дали экстренную информацию о восстановлении после коронавируса, и о лечении этой болезни.
В этом видео мы рассказали, что, судя по отзывам, многим людям при коронавирусе очень быстро помогает раствор Метиленового синего.
К такому же выводу пришли российские ученые из Сеченовского университета
https://www.sechenov.ru/pressroom/news/ ... oronaviru/
Противопоказаний к такому лечению очень немного:
Первое противопоказание — это, конечно, аллергия на сам Метиленовый синий.
Второе — беременность и кормление грудью; детский возраст до 12-ти лет.
Третье. Метиленовый синий является ингибитором моноаминоксидазы, поэтому его нельзя принимать внутрь одновременно с приёмом антидепрессантов группы селективных ингибиторов обратного захвата серотонина.
Как принимать:
Для лечения в данном случае используется строго 1% водный раствор Метиленового синего.
10 капель этого 1%-го водного раствора Метиленового синего обычно разводят в целом стакане воды
(но в первый раз лучше начать с 5 капель).
Вода должна быть НЕ горячей, но и не слишком холодной. В идеале – комнатной температуры.
Выпивается этот стакан МЕДЛЕННО, 1 раз в день, курс 3-5 дней, максимум 7 дней.
В случае крайней необходимости, и только при хорошей переносимости, такой раствор пьют 2 раза в день.
По отзывам моих друзей и знакомых, практиковавших этом метод, облегчение при приеме такого раствора при коронавирусе в большинстве случаев наступало очень быстро, буквально за 1 день.
Применяется он и для более быстрого восстановления после болезни.
Метиленовый синий стоит ОЧЕНЬ дёшево.
Но главная проблема – его оказалось очень трудно найти в аптеках. Приходится заказывать по интернету.
На первый взгляд, всё это может показаться очень странно:
как какой-то метиленовый синий может помочь в серьезной ситуации?
Но на самом деле, приём метиленового синего внутрь в медицине не новость:
он давно используется при лечении малярии и болезни Альцгеймера; обладает ярким противовирусным эффектом, что было доказано при лечении Эболы и MERS-CoV.
Прочитать об этом можно, например, в Википедии https://ru.wikipedia.org/wiki/Метиленовый_синий
Или здесь https://bloknot.ru/nauka/sin-ka-nas-spa ... 28201.html
Источник о Метиленовом синем на английском здесь https://riviste.fupress.net/index.php/s ... e/view/888
Так что ничего удивительного в эффективности Метиленового синего нет.
А вот (случайное?) забывание и замалчивание крайне дешёвого и эффективного средства – налицо.
***
Автор статьи — доктор Евдокименко©.
Метиленовый синий при коронавирусе: неожиданная информация
Автор: EVDOKIMENKO · 29.01.2021
Недавно у нас вышло видео, в котором мы дали экстренную информацию о восстановлении после коронавируса, и о лечении этой болезни.
В этом видео мы рассказали, что, судя по отзывам, многим людям при коронавирусе очень быстро помогает раствор Метиленового синего.
К такому же выводу пришли российские ученые из Сеченовского университета
https://www.sechenov.ru/pressroom/news/ ... oronaviru/
Противопоказаний к такому лечению очень немного:
Первое противопоказание — это, конечно, аллергия на сам Метиленовый синий.
Второе — беременность и кормление грудью; детский возраст до 12-ти лет.
Третье. Метиленовый синий является ингибитором моноаминоксидазы, поэтому его нельзя принимать внутрь одновременно с приёмом антидепрессантов группы селективных ингибиторов обратного захвата серотонина.
Как принимать:
Для лечения в данном случае используется строго 1% водный раствор Метиленового синего.
10 капель этого 1%-го водного раствора Метиленового синего обычно разводят в целом стакане воды
(но в первый раз лучше начать с 5 капель).
Вода должна быть НЕ горячей, но и не слишком холодной. В идеале – комнатной температуры.
Выпивается этот стакан МЕДЛЕННО, 1 раз в день, курс 3-5 дней, максимум 7 дней.
В случае крайней необходимости, и только при хорошей переносимости, такой раствор пьют 2 раза в день.
По отзывам моих друзей и знакомых, практиковавших этом метод, облегчение при приеме такого раствора при коронавирусе в большинстве случаев наступало очень быстро, буквально за 1 день.
Применяется он и для более быстрого восстановления после болезни.
Метиленовый синий стоит ОЧЕНЬ дёшево.
Но главная проблема – его оказалось очень трудно найти в аптеках. Приходится заказывать по интернету.
На первый взгляд, всё это может показаться очень странно:
как какой-то метиленовый синий может помочь в серьезной ситуации?
Но на самом деле, приём метиленового синего внутрь в медицине не новость:
он давно используется при лечении малярии и болезни Альцгеймера; обладает ярким противовирусным эффектом, что было доказано при лечении Эболы и MERS-CoV.
Прочитать об этом можно, например, в Википедии https://ru.wikipedia.org/wiki/Метиленовый_синий
Или здесь https://bloknot.ru/nauka/sin-ka-nas-spa ... 28201.html
Источник о Метиленовом синем на английском здесь https://riviste.fupress.net/index.php/s ... e/view/888
Так что ничего удивительного в эффективности Метиленового синего нет.
А вот (случайное?) забывание и замалчивание крайне дешёвого и эффективного средства – налицо.
***
Автор статьи — доктор Евдокименко©.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.sciencedirect.com/science/a ... 5209003359
Methylene blue and Alzheimer's disease
(окт 2009)
Метиленовый синий и болезнь Альцгеймера
Абстракт
Связь между метиленовым синим (МС) и болезнью Альцгеймера (БА) в последнее время привлекает все большее внимание ученых, поскольку было высказано предположение, что МС может замедлять прогрессирование этого заболевания.
Фактически, MС, в дополнение к его хорошо охарактеризованному ингибирующему действию на путь цГМФ, влияет на многочисленные клеточные и молекулярные события, тесно связанные с прогрессированием БА. В настоящее время было показано, что MС ослабляет образование амилоидных бляшек и нейрофибриллярных клубков, а также частично восстанавливает нарушения митохондриальной функции и клеточного метаболизма.
Кроме того, MС также влияет на различные нейротрансмиттерные системы (холинергическую, серотонинергическую и глутаматергическую), которые, как считается, играют важную роль в патогенезе БА и других когнитивных расстройств.
Недавние исследования показывают, что комбинация различных действий MС на эти клеточные функции, вероятно, опосредует потенциальные полезные эффекты MС. Это привело к попыткам разработать новые методы лечения БА на основе MС.
В этой обзорной статье действия MС на нейротрансмиттерные системы и множественные клеточные и молекулярные мишени суммированы с точки зрения их отношения к болезни Альцгеймера.
Введение
Исторически сложилось так, что метиленовый синий (МС) является первым синтетическим соединением, когда-либо использовавшимся в качестве антисептика в клинической терапии, и первым антисептическим красителем, который использовался в терапевтических целях [1], [2]. Фактически использование MС и его производных было широко распространено в химиотерапии до появления сульфаниламидов и пенициллина [см. обзор 1]. MС также был ведущим соединением в исследованиях лекарств против различных бактериальных и вирусных инфекций [1] и рака [1], [3]. Исследования его структуры и терапевтической активности сыграли важную роль в разработке фенотиазинов [2], [3], [4], большого класса препаратов, используемых в качестве антигистаминных и нейролептиков.
Благотворное влияние МС при лечении когнитивных расстройств, возникающих при психозах, известно уже более века [5]. Недавно внимание привлекла его способность замедлять снижение когнитивных функций при болезни Альцгеймера (БА) [6], [7], [8]. БА является наиболее частой причиной деменции у пожилых людей. Клинически он характеризуется прогрессирующими когнитивными нарушениями и тяжелыми нервно-психическими расстройствами [8], [9]. Гистопатологическими признаками являются внеклеточные отложения β-амилоидного белка (Aβ, 40–42-аминокислотный протеолитический фрагмент белка-предшественника амилоида, APP) в нейритных бляшках, внутриклеточные нейрофибриллярные клубки, вызванные аномальной агрегацией тау-белка и потерей нейронов. особенно влияя на холинергическую систему [9].
В настоящем обзоре обобщены данные, свидетельствующие о том, что MС является многообещающим кандидатом, который может помочь предотвратить снижение когнитивных функций при БА.
Фрагменты раздела
Биохимическая фармакология
MС, катионный краситель с химическим названием тетраметилтионин хлорид, принадлежит к классу соединений, известных как фенотиазины. Он растворим в воде, а также может растворяться в органических растворителях [10]. Его цвет темно-синий в окисленном состоянии (MС) с максимальным поглощением при длинах волн света 609 и 668 нм [11] и бесцветный при восстановлении до leucoMС, не поглощающего в видимой области. Эти две формы красителя существуют в виде окислительно-восстановительной пары в равновесии; вместе они образуют
МС и амилоидные бляшки
Агрегация Aβ, которая приводит к внеклеточным фибриллярным отложениям, известным как амилоидные бляшки, представляет собой сложный процесс, включающий растворимые мономеры, олигомеры и образование фибрилл. Хотя механизмы, лежащие в основе олигомеризации и образования фибрилл, четко не выяснены, было показано, что MС ингибирует олигомеризацию Aβ42 со значением IC50 12,4 мкМ в биохимических исследованиях in vitro [40]. Ингибирование олигомеризации Aβ42 MС наблюдалось одновременно с дозозависимым усилением фибрилляции,
МС и нейрофибриллярные клубки
Внутриклеточные нейрофибриллярные поражения состоят из парных спиральных филаментов и прямых филаментов, которые состоят из тау-белка, ассоциированного с микротрубочками, в гиперфосфорилированном состоянии [45]. Временное и пространственное накопление гиперфосфорилированного тау-белка коррелирует с потерей нервных клеток и тяжестью деменции. В более раннем исследовании [45] образование агрегатов из укороченного тау-белка ингибировалось рядом фенотиазинов, в том числе MС (IC50 = 3,7 мкМ) и его
МС и холинергическая система
Холинергическая система играет важную роль в регуляции обучения и памяти. Кроме того, исследования как in vitro, так и in vivo последовательно демонстрировали связь между холинергической активацией и белковым метаболизмом в амилоидных бляшках. Поражение холинергических ядер вызывает быстрое увеличение кортикальных амилоидных бляшек [47], [48]. Точно так же снижение холинергической нейротрансмиссии приводит к амилоидогенному метаболизму и способствует невропатологии и когнитивной дисфункции у
МС и серотонинергическая система
В то время как снижение когнитивных функций при БА может быть в значительной степени связано с холинергической дисфункцией, поведенческие и психологические симптомы, связанные с БА, скорее всего, вызваны нарушением баланса между несколькими другими нейротрансмиттерами, при этом ключевую роль играет серотонин (5-НТ) [64]. ]. У пациентов с БА обнаруживаются многочисленные аномалии серотонинергической системы, в том числе заметное истощение 5-НТ и его метаболита 5-гидроксииндолуксусной кислоты (5-ГИУК) в лобной и височной коре.
МС и глутаматергическая система
Другой важной нейротрансмиттерной системой, на которую влияет МС, является глутаматергическая система. В срезах гиппокампа крыс синаптическую передачу, опосредованную глутаматом, отменяют относительно высокие концентрации (5–50 мкМ) MС [72]. С другой стороны, известно, что MС усиливает сохранение памяти [73], [74] и другие функции мозга, в которых участвуют ионотропные рецепторы глутамата [75], [76]. Принимая во внимание важную роль рецепторов NMDA в долгосрочной потенциации и других событиях, связанных с синаптической
МС и митохондриальная функция
Также было показано, что препараты, успешно воздействующие на нарушенное митохондриальное дыхание, улучшают выработку нейронной энергии и консолидацию памяти [см. обзор 77]. Фактически, MС также является одним из таких соединений. Он проникает через клеточные и митохондриальные мембраны, накапливается в митохондриях [78] и улучшает митохондриальное дыхание в низких концентрациях (0,5–2 мкМ), перемещая электроны к кислороду в электрон-транспортной цепи, и корректирует нарушенные
Вывод
MС обладает многими свойствами, ожидаемыми от препарата, который, как ожидается, будет действовать на мозг. Из них его высокая растворимость в водной среде, его низкая токсичность, его способность преодолевать гематоэнцефалический барьер и клеточные мембраны, а также его одобрение для использования у людей делают его особенно привлекательным в качестве потенциального терапевтического агента. Влияние МС на холинергическую, серотонинергическую и глутаматергическую нейротрансмиттерные системы, на функцию митохондрий и на образование амилоидных бляшек и нейрофибриллярных
Methylene blue and Alzheimer's disease
(окт 2009)
Метиленовый синий и болезнь Альцгеймера
Абстракт
Связь между метиленовым синим (МС) и болезнью Альцгеймера (БА) в последнее время привлекает все большее внимание ученых, поскольку было высказано предположение, что МС может замедлять прогрессирование этого заболевания.
Фактически, MС, в дополнение к его хорошо охарактеризованному ингибирующему действию на путь цГМФ, влияет на многочисленные клеточные и молекулярные события, тесно связанные с прогрессированием БА. В настоящее время было показано, что MС ослабляет образование амилоидных бляшек и нейрофибриллярных клубков, а также частично восстанавливает нарушения митохондриальной функции и клеточного метаболизма.
Кроме того, MС также влияет на различные нейротрансмиттерные системы (холинергическую, серотонинергическую и глутаматергическую), которые, как считается, играют важную роль в патогенезе БА и других когнитивных расстройств.
Недавние исследования показывают, что комбинация различных действий MС на эти клеточные функции, вероятно, опосредует потенциальные полезные эффекты MС. Это привело к попыткам разработать новые методы лечения БА на основе MС.
В этой обзорной статье действия MС на нейротрансмиттерные системы и множественные клеточные и молекулярные мишени суммированы с точки зрения их отношения к болезни Альцгеймера.
Введение
Исторически сложилось так, что метиленовый синий (МС) является первым синтетическим соединением, когда-либо использовавшимся в качестве антисептика в клинической терапии, и первым антисептическим красителем, который использовался в терапевтических целях [1], [2]. Фактически использование MС и его производных было широко распространено в химиотерапии до появления сульфаниламидов и пенициллина [см. обзор 1]. MС также был ведущим соединением в исследованиях лекарств против различных бактериальных и вирусных инфекций [1] и рака [1], [3]. Исследования его структуры и терапевтической активности сыграли важную роль в разработке фенотиазинов [2], [3], [4], большого класса препаратов, используемых в качестве антигистаминных и нейролептиков.
Благотворное влияние МС при лечении когнитивных расстройств, возникающих при психозах, известно уже более века [5]. Недавно внимание привлекла его способность замедлять снижение когнитивных функций при болезни Альцгеймера (БА) [6], [7], [8]. БА является наиболее частой причиной деменции у пожилых людей. Клинически он характеризуется прогрессирующими когнитивными нарушениями и тяжелыми нервно-психическими расстройствами [8], [9]. Гистопатологическими признаками являются внеклеточные отложения β-амилоидного белка (Aβ, 40–42-аминокислотный протеолитический фрагмент белка-предшественника амилоида, APP) в нейритных бляшках, внутриклеточные нейрофибриллярные клубки, вызванные аномальной агрегацией тау-белка и потерей нейронов. особенно влияя на холинергическую систему [9].
В настоящем обзоре обобщены данные, свидетельствующие о том, что MС является многообещающим кандидатом, который может помочь предотвратить снижение когнитивных функций при БА.
Фрагменты раздела
Биохимическая фармакология
MС, катионный краситель с химическим названием тетраметилтионин хлорид, принадлежит к классу соединений, известных как фенотиазины. Он растворим в воде, а также может растворяться в органических растворителях [10]. Его цвет темно-синий в окисленном состоянии (MС) с максимальным поглощением при длинах волн света 609 и 668 нм [11] и бесцветный при восстановлении до leucoMС, не поглощающего в видимой области. Эти две формы красителя существуют в виде окислительно-восстановительной пары в равновесии; вместе они образуют
МС и амилоидные бляшки
Агрегация Aβ, которая приводит к внеклеточным фибриллярным отложениям, известным как амилоидные бляшки, представляет собой сложный процесс, включающий растворимые мономеры, олигомеры и образование фибрилл. Хотя механизмы, лежащие в основе олигомеризации и образования фибрилл, четко не выяснены, было показано, что MС ингибирует олигомеризацию Aβ42 со значением IC50 12,4 мкМ в биохимических исследованиях in vitro [40]. Ингибирование олигомеризации Aβ42 MС наблюдалось одновременно с дозозависимым усилением фибрилляции,
МС и нейрофибриллярные клубки
Внутриклеточные нейрофибриллярные поражения состоят из парных спиральных филаментов и прямых филаментов, которые состоят из тау-белка, ассоциированного с микротрубочками, в гиперфосфорилированном состоянии [45]. Временное и пространственное накопление гиперфосфорилированного тау-белка коррелирует с потерей нервных клеток и тяжестью деменции. В более раннем исследовании [45] образование агрегатов из укороченного тау-белка ингибировалось рядом фенотиазинов, в том числе MС (IC50 = 3,7 мкМ) и его
МС и холинергическая система
Холинергическая система играет важную роль в регуляции обучения и памяти. Кроме того, исследования как in vitro, так и in vivo последовательно демонстрировали связь между холинергической активацией и белковым метаболизмом в амилоидных бляшках. Поражение холинергических ядер вызывает быстрое увеличение кортикальных амилоидных бляшек [47], [48]. Точно так же снижение холинергической нейротрансмиссии приводит к амилоидогенному метаболизму и способствует невропатологии и когнитивной дисфункции у
МС и серотонинергическая система
В то время как снижение когнитивных функций при БА может быть в значительной степени связано с холинергической дисфункцией, поведенческие и психологические симптомы, связанные с БА, скорее всего, вызваны нарушением баланса между несколькими другими нейротрансмиттерами, при этом ключевую роль играет серотонин (5-НТ) [64]. ]. У пациентов с БА обнаруживаются многочисленные аномалии серотонинергической системы, в том числе заметное истощение 5-НТ и его метаболита 5-гидроксииндолуксусной кислоты (5-ГИУК) в лобной и височной коре.
МС и глутаматергическая система
Другой важной нейротрансмиттерной системой, на которую влияет МС, является глутаматергическая система. В срезах гиппокампа крыс синаптическую передачу, опосредованную глутаматом, отменяют относительно высокие концентрации (5–50 мкМ) MС [72]. С другой стороны, известно, что MС усиливает сохранение памяти [73], [74] и другие функции мозга, в которых участвуют ионотропные рецепторы глутамата [75], [76]. Принимая во внимание важную роль рецепторов NMDA в долгосрочной потенциации и других событиях, связанных с синаптической
МС и митохондриальная функция
Также было показано, что препараты, успешно воздействующие на нарушенное митохондриальное дыхание, улучшают выработку нейронной энергии и консолидацию памяти [см. обзор 77]. Фактически, MС также является одним из таких соединений. Он проникает через клеточные и митохондриальные мембраны, накапливается в митохондриях [78] и улучшает митохондриальное дыхание в низких концентрациях (0,5–2 мкМ), перемещая электроны к кислороду в электрон-транспортной цепи, и корректирует нарушенные
Вывод
MС обладает многими свойствами, ожидаемыми от препарата, который, как ожидается, будет действовать на мозг. Из них его высокая растворимость в водной среде, его низкая токсичность, его способность преодолевать гематоэнцефалический барьер и клеточные мембраны, а также его одобрение для использования у людей делают его особенно привлекательным в качестве потенциального терапевтического агента. Влияние МС на холинергическую, серотонинергическую и глутаматергическую нейротрансмиттерные системы, на функцию митохондрий и на образование амилоидных бляшек и нейрофибриллярных
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://aptekamos.ru/tovary/lekarstva/m ... 87677/ceni
https://apteka.ru/product/metilenovyj-s ... 0018fe009/
https://www.asna.ru/product/metilenovyy_siniy/
https://uteka.ru/product/metilenovyj-sinij-60465/

И в зоомагазинах продают. Но не знаю, можно ли этот принимать внутрь, насколько он чистый.

https://apteka.ru/product/metilenovyj-s ... 0018fe009/
https://www.asna.ru/product/metilenovyy_siniy/
https://uteka.ru/product/metilenovyj-sinij-60465/


И в зоомагазинах продают. Но не знаю, можно ли этот принимать внутрь, насколько он чистый.

-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://riviste.fupress.net/index.php/s ... e/view/888
A cohort of cancer patients with no reported cases of SARS-CoV-2 infection: the possible preventive role of Methylene Blue
Когорта онкологических больных, у которых не было зарегистрировано случаев заражения SARS-CoV-2: возможная профилактическая роль метиленового синего
Абстракт
Мы сообщаем о случае когорты из 2500 французских пациентов, получавших, среди прочего, метиленовый синий для лечения рака. Во время эпидемии COVID-19 ни у кого из них не развилось гриппоподобное заболевание. Хотя это отсутствие инфекции может быть случайным, вполне возможно, что метиленовый синий может оказывать профилактическое действие на инфекцию COVID-19. Это соответствует противовирусной активности хлорохина, производного метиленового синего. И хлорохин, и метиленовый синий обладают сильными противовирусными и противовоспалительными свойствами, вероятно, связанными с изменением внутриклеточного рН и окислительно-восстановительного состояния.
A cohort of cancer patients with no reported cases of SARS-CoV-2 infection: the possible preventive role of Methylene Blue
Когорта онкологических больных, у которых не было зарегистрировано случаев заражения SARS-CoV-2: возможная профилактическая роль метиленового синего
Абстракт
Мы сообщаем о случае когорты из 2500 французских пациентов, получавших, среди прочего, метиленовый синий для лечения рака. Во время эпидемии COVID-19 ни у кого из них не развилось гриппоподобное заболевание. Хотя это отсутствие инфекции может быть случайным, вполне возможно, что метиленовый синий может оказывать профилактическое действие на инфекцию COVID-19. Это соответствует противовирусной активности хлорохина, производного метиленового синего. И хлорохин, и метиленовый синий обладают сильными противовирусными и противовоспалительными свойствами, вероятно, связанными с изменением внутриклеточного рН и окислительно-восстановительного состояния.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3087269/
Methylene Blue: Revisited
(окт-дек 2010)
Метиленовый синий: новый взгляд
Метиленовый синий, ингибитор синтазы оксида азота и гуанилатциклазы, имеет множество применений в медицине. Было обнаружено, что он улучшает гипотензию, связанную с различными клиническими состояниями. Он также улучшает гипоксию и гипердинамическую циркуляцию при циррозе печени и тяжелом гепатопульмональном синдроме. Он также приводит к временному и воспроизводимому улучшению артериального давления и сердечной функции при септическом шоке.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ КАТЕХОЛАМИНРЕФРАКТОРНОЙ ВАЗОПЛЕГИИ
Вазоплегический синдром обычно определяется как артериальное давление <50 мм рт.ст., сердечный индекс >2,5 л/мин/м2, давление в правом предсердии <5 мм рт.ст., давление в левом предсердии <10 мм рт.ст. и низкое системное сосудистое сопротивление <800 дин/сек/ см5.
Факторы риска вазоплегии
Недавние исследования установили различные факторы риска послеоперационной вазоплегии. К ним относятся предоперационное использование гепарина, ингибиторов АПФ, застойная сердечная недостаточность, плохая функция левого желудочка, продолжительность искусственного кровообращения (ИК), повторная операция, возраст пациента и опиоидная анестезия.
Механизм действия метиленового синего при вазоплегии
Было высказано предположение, что рефрактерная вазоплегия может отражать нарушение регуляции синтеза оксида азота и активации гуанилатциклазы гладких клеток сосудов. На основании недавних патофизиологических данных видно, что растворимый внутриклеточный фермент гуанилатциклаза активируется с образованием циклического гуанозинмонофосфата (C-GMP), предположительно, под влиянием нескольких медиаторов, включая оксид азота.
Метиленовый синий ингибирует гуанилатциклазу, тем самым снижая уровень C-GMP и релаксацию гладкой мускулатуры сосудов.
Предоперационное применение в кардиохирургии
Метиленовый синий (1%) применялся внутривенно в течение 30 минут в отделении интенсивной терапии за 1 час до операции и выявил снижение частоты и тяжести вазоплегического синдрома у пациентов с высоким риском.
Интраоперационный
Он также успешно добавлялся к первичному искусственному кровообращению (2 мг/кг) и продолжался в виде инфузии (0,25–2 мг/кг/ч) во время искусственного кровообращения для лечения рефрактерной гипотензии при септическом эндокардите.
Послеоперационный
Его также можно использовать для лечения тяжелой вазоплегии у пациентов после операции по пересадке органов. Следовательно, исследования пришли к выводу о снижении смертности у пациентов с вазоплегией после операций на сердце с применением метиленового синего по сравнению с плацебо.
Дозировка
Метиленовый синий используется однократно в дозе 1,5–2 мг/кг внутривенно в течение 20 мин–1 ч для неотложной терапии.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ СЕПТИЧЕСКОМ ШОКЕ
Высвобождение оксида азота связывают с сердечно-сосудистыми изменениями при септическом шоке. Поскольку гуанилатциклаза является ферментом-мишенью в эндотелийзависимой релаксации, опосредованной оксидом азота, было обнаружено, что метиленовый синий — мощный ингибитор гуанилатциклазы — очень эффективен для улучшения артериального давления и сердечной функции при септическом шоке.
Исследования показали улучшение среднего артериального давления (САД) и системного сосудистого сопротивления (СССС) при одновременном снижении потребности в вазопрессорах при септическом шоке.
МЕТИЛЕНОВЫЙ СИНИЙ И ГЕПАТОЛЕГОЧНЫЙ СИНДРОМ
Гипоксемия при гепатопульмональном синдроме возникает в результате распространенной легочной вазодилатации из-за повышения уровня C-GMP. Метиленовый синий соответствует ↑PaO2 и ↓альвеолярно-артериальной разнице парциального давления кислорода у всех больных с гепатопульмональным синдромом. Это произошло из-за уровней ↓C-GMP под действием метиленового синего — сильного ингибитора гуанилатциклазы.
МЕТИЛЕНОВЫЙ СИНИЙ КАК ПРОТИВОМАЛЯРИЙНОЕ СРЕДСТВО
Метиленовый синий уже использовался около 100 лет назад против малярии, но он исчез, когда на рынке появились хлорохин (CQ) и другие лекарства. Однако недавние исследования показали эффективность метиленового синего как эффективного и дешевого противомалярийного средства, особенно в странах с растущей устойчивостью P. falciparum к существующим противомалярийным средствам 1-й линии - CQ и пириметамин-сульфадоксин.
Метиленовый синий, специфический ингибитор глутатионредуктазы P.falciparum, может обратить вспять устойчивость к CQ и предотвратить полимеризацию гема в гемозоин, подобно 4-аминохинолиновым противомалярийным средствам.
Наиболее эффективна доза 36-72 мг/кг в течение 3 дней.
Помимо внутренней противомалярийной активности и сенсибилизирующего действия CQ, также считалось, что он предотвращает метгемоглобинемию — серьезное осложнение малярийной анемии.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ МЕТГЕМОГЛОБИНЕМИИ
Метгемоглобинемия — опасное для жизни состояние, которое может быть врожденным или приобретенным. Он характеризуется неспособностью гемоглобина переносить кислород из-за окисления двухвалентной части молекулы гема до трехвалентного состояния.
Метиленовый синий действует, реагируя внутри эритроцитов с образованием лейкометиленового синего, который является восстановителем окисленного гемоглобина, превращая ион трехвалентного железа (fe+++) обратно в его кислородсодержащее двухвалентное состояние (fe++).
Обычно используемая доза составляет 1-2 мг/кг 1% раствора метиленового синего.
МЕТИЛЕНОВЫЙ СИНИЙ И РАК
Недавние исследования показывают, что метиленовый синий и другие окислительно-восстановительные циклеры индуцируют селективный апоптоз раковых клеток за счет НАД (Ф) Н: зависимой от хинина оксидоредуктазы (NQO1) биоредуктивной генерации клеточного окислительного стресса. Следовательно, метиленовый синий исследуется для фотодинамического лечения рака.
ИФОСФАМИД НЕЙРОТОКСИЧЕСКИЙ
Другое, менее известное применение метиленового синего — это его применение для лечения нейротоксичности ифосфамида. Токсичный метаболит ифосфамида, хлорацетальдегид, разрушает митохондриальную дыхательную цепь, что приводит к накоплению никотинамидадениндинуклеотидного водорода (НАДН).
Метиленовый синий действует как альтернативный акцептор электронов и обращает ингибирование NADH глюконеогенеза в печени, а также ингибирует превращение хлорэтиламина в хлорацетальдегид, а также ингибирует активность многих аминоксидаз, предотвращая образование хлорацетальдегида.
Следовательно, он играет профилактическую и терапевтическую роль при индуцированной ифосфамидом энцефалопатии.
МЕТИЛЕНОВЫЙ СИНИЙ КАК КРАСИТЕЛЬ
Было обнаружено, что инфузия метиленового синего является безопасным и эффективным методом локализации аномальных паращитовидных желез.
Метиленовый синий также использовался для интраоперационной эндоскопической маркировки просвета кишечника для определения местоположения поражений.
Метиленовый синий также оказался эффективной и дешевой альтернативой красителю изосульфанового синего для локализации сигнальных лимфатических узлов у пациентов с раком молочной железы.
Метиленовый синий также использовался в диагностической микробиологии в качестве красителя. Это недорогой и быстрый метод обнаружения H.pylori.
НЕЙТРАЛИЗАЦИЯ ГЕПАРИНА
Метиленовый синий эффективно нейтрализует гепарин, особенно у пациентов с аллергией на протамины. Однако еще предстоит провести работу, чтобы определить безопасность препарата в более высоких дозах, необходимых для нейтрализации уровней гепарина, достигнутых у пациентов с шунтированием.
МЕТИЛЕНОВЫЙ СИНИЙ И ПРИАПИЗМ
Метиленовый синий использовался для лечения приапизма с высоким потоком путем внутрикавернозной инъекции, которая, как известно, противодействует эндотелиальному фактору релаксации.
МЕТИЛЕНОВЫЙ СИНИЙ И БОЛЕЗНЬ АЛЬЦГЕЙМЕРА
Связь между метиленовым синим и болезнью Альцгеймера в последнее время привлекает все большее внимание ученых. Было показано, что он ослабляет образование амилоидных бляшек и нейрофибриллярных клубков и частично восстанавливает нарушения митохондриальной функции и клеточного метаболизма.
МЕТИЛЕНОВЫЙ СИНИЙ В СОЧЕТАНИИ СО СВЕТОМ
Фотодинамическая терапия с использованием активируемого светом антимикробного агента метиленового синего убивает метициллин-резистентный золотистый стафилококк (MRSA) в поверхностных и глубоких эксцизионных ранах. Метиленовый синий в сочетании со светом также инактивирует нуклеиновую кислоту вируса гепатита С и вируса иммунодефицита человека (HIV-1) и лечит случаи резистентного бляшечного псориаза.
ПОБОЧНЫЕ ЭФФЕКТЫ
Метиленовый синий является безопасным препаратом при использовании в терапевтических дозах (<2 мг/кг). Но он может вызывать токсичность в высоких дозах. Признаками токсичности являются сердечные аритмии, коронарная вазоконстрикция, снижение сердечного выброса, почечного кровотока и мезентериального кровотока; повышение легочного сосудистого давления и легочного сосудистого сопротивления и ухудшение газообмена. Он также окрашивает мочу в зеленовато-синий цвет и придает синюшный цвет коже и слизистой оболочке, что является самоограничивающимся.
Из-за его тканевых свойств сообщалось о случае некроза кожи и жировой ткани с последующей сухой гангреной кожи у пациентки с раком молочной железы, которой была проведена биопсия сторожевого лимфатического узла с использованием перитуморальной инъекции красителя метиленового синего.
Он также может вызывать гемолитическую анемию, характеризующуюся образованием телец Хайнца, особенно у пациентов с тяжелой почечной недостаточностью и дефицитом глюкозо-6-фосфатдегидрогеназы (Г6ФД).
Новорожденные особенно подвержены неблагоприятному воздействию метиленового синего. Он вызывает гипербилирубинемию, образование мет-гемоглобина, гемолитическую анемию, респираторный дистресс, отек легких, фототоксичность и голубоватое окрашивание трахеального секрета и мочи.
Метиленовый синий также мешает световому излучению пульсоксиметра, что приводит к ложно заниженным показаниям насыщения кислородом.
Метиленовый синий из-за его свойства ингибировать моноаминоксидазу (МАО) может спровоцировать потенциально фатальную токсичность серотонина в дозах > 5 мг/кг и редко может вызвать тяжелый анафилактический шок.
ПРОТИВОПОКАЗАНИЯ
Метиленовый синий противопоказан больным с развившимися на него реакциями гиперчувствительности и при тяжелой почечной недостаточности. Он относительно противопоказан пациентам с дефицитом G6PD, так как может вызвать тяжелый гемолиз, а также пациентам с анемией с тельцами Хайнца.
ВЗАИМОДЕЙСТВИЕ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Метиленовый синий является ингибитором МАО и поэтому может взаимодействовать с селективным ингибитором обратного захвата серотонина (СИОЗС) и ингибиторами МАО, вызывая серьезную токсичность серотонина.
Он также взаимодействует с дапсоном и образует гидроксиламин, который окисляет гемоглобин, вызывая гемолиз.
ВЫВОДЫ
Метиленовый синий до сих пор был известен в основном как краситель, но теперь он входит в область кардиохирургии и интенсивной терапии в качестве очень важного терапевтического агента с разнообразными применениями. Доказательства его использования при метгемоглобинемии хорошо известны, но его использование при вазоплегии, септическом шоке, гепатопульмональном синдроме, малярии, нейротоксичности ифосфамида и т. д. ограничено, но многообещающе и требует дополнительных исследований.
Methylene Blue: Revisited
(окт-дек 2010)
Метиленовый синий: новый взгляд
Метиленовый синий, ингибитор синтазы оксида азота и гуанилатциклазы, имеет множество применений в медицине. Было обнаружено, что он улучшает гипотензию, связанную с различными клиническими состояниями. Он также улучшает гипоксию и гипердинамическую циркуляцию при циррозе печени и тяжелом гепатопульмональном синдроме. Он также приводит к временному и воспроизводимому улучшению артериального давления и сердечной функции при септическом шоке.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ КАТЕХОЛАМИНРЕФРАКТОРНОЙ ВАЗОПЛЕГИИ
Вазоплегический синдром обычно определяется как артериальное давление <50 мм рт.ст., сердечный индекс >2,5 л/мин/м2, давление в правом предсердии <5 мм рт.ст., давление в левом предсердии <10 мм рт.ст. и низкое системное сосудистое сопротивление <800 дин/сек/ см5.
Факторы риска вазоплегии
Недавние исследования установили различные факторы риска послеоперационной вазоплегии. К ним относятся предоперационное использование гепарина, ингибиторов АПФ, застойная сердечная недостаточность, плохая функция левого желудочка, продолжительность искусственного кровообращения (ИК), повторная операция, возраст пациента и опиоидная анестезия.
Механизм действия метиленового синего при вазоплегии
Было высказано предположение, что рефрактерная вазоплегия может отражать нарушение регуляции синтеза оксида азота и активации гуанилатциклазы гладких клеток сосудов. На основании недавних патофизиологических данных видно, что растворимый внутриклеточный фермент гуанилатциклаза активируется с образованием циклического гуанозинмонофосфата (C-GMP), предположительно, под влиянием нескольких медиаторов, включая оксид азота.
Метиленовый синий ингибирует гуанилатциклазу, тем самым снижая уровень C-GMP и релаксацию гладкой мускулатуры сосудов.
Предоперационное применение в кардиохирургии
Метиленовый синий (1%) применялся внутривенно в течение 30 минут в отделении интенсивной терапии за 1 час до операции и выявил снижение частоты и тяжести вазоплегического синдрома у пациентов с высоким риском.
Интраоперационный
Он также успешно добавлялся к первичному искусственному кровообращению (2 мг/кг) и продолжался в виде инфузии (0,25–2 мг/кг/ч) во время искусственного кровообращения для лечения рефрактерной гипотензии при септическом эндокардите.
Послеоперационный
Его также можно использовать для лечения тяжелой вазоплегии у пациентов после операции по пересадке органов. Следовательно, исследования пришли к выводу о снижении смертности у пациентов с вазоплегией после операций на сердце с применением метиленового синего по сравнению с плацебо.
Дозировка
Метиленовый синий используется однократно в дозе 1,5–2 мг/кг внутривенно в течение 20 мин–1 ч для неотложной терапии.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ СЕПТИЧЕСКОМ ШОКЕ
Высвобождение оксида азота связывают с сердечно-сосудистыми изменениями при септическом шоке. Поскольку гуанилатциклаза является ферментом-мишенью в эндотелийзависимой релаксации, опосредованной оксидом азота, было обнаружено, что метиленовый синий — мощный ингибитор гуанилатциклазы — очень эффективен для улучшения артериального давления и сердечной функции при септическом шоке.
Исследования показали улучшение среднего артериального давления (САД) и системного сосудистого сопротивления (СССС) при одновременном снижении потребности в вазопрессорах при септическом шоке.
МЕТИЛЕНОВЫЙ СИНИЙ И ГЕПАТОЛЕГОЧНЫЙ СИНДРОМ
Гипоксемия при гепатопульмональном синдроме возникает в результате распространенной легочной вазодилатации из-за повышения уровня C-GMP. Метиленовый синий соответствует ↑PaO2 и ↓альвеолярно-артериальной разнице парциального давления кислорода у всех больных с гепатопульмональным синдромом. Это произошло из-за уровней ↓C-GMP под действием метиленового синего — сильного ингибитора гуанилатциклазы.
МЕТИЛЕНОВЫЙ СИНИЙ КАК ПРОТИВОМАЛЯРИЙНОЕ СРЕДСТВО
Метиленовый синий уже использовался около 100 лет назад против малярии, но он исчез, когда на рынке появились хлорохин (CQ) и другие лекарства. Однако недавние исследования показали эффективность метиленового синего как эффективного и дешевого противомалярийного средства, особенно в странах с растущей устойчивостью P. falciparum к существующим противомалярийным средствам 1-й линии - CQ и пириметамин-сульфадоксин.
Метиленовый синий, специфический ингибитор глутатионредуктазы P.falciparum, может обратить вспять устойчивость к CQ и предотвратить полимеризацию гема в гемозоин, подобно 4-аминохинолиновым противомалярийным средствам.
Наиболее эффективна доза 36-72 мг/кг в течение 3 дней.
Помимо внутренней противомалярийной активности и сенсибилизирующего действия CQ, также считалось, что он предотвращает метгемоглобинемию — серьезное осложнение малярийной анемии.
МЕТИЛЕНОВЫЙ СИНИЙ ПРИ МЕТГЕМОГЛОБИНЕМИИ
Метгемоглобинемия — опасное для жизни состояние, которое может быть врожденным или приобретенным. Он характеризуется неспособностью гемоглобина переносить кислород из-за окисления двухвалентной части молекулы гема до трехвалентного состояния.
Метиленовый синий действует, реагируя внутри эритроцитов с образованием лейкометиленового синего, который является восстановителем окисленного гемоглобина, превращая ион трехвалентного железа (fe+++) обратно в его кислородсодержащее двухвалентное состояние (fe++).
Обычно используемая доза составляет 1-2 мг/кг 1% раствора метиленового синего.
МЕТИЛЕНОВЫЙ СИНИЙ И РАК
Недавние исследования показывают, что метиленовый синий и другие окислительно-восстановительные циклеры индуцируют селективный апоптоз раковых клеток за счет НАД (Ф) Н: зависимой от хинина оксидоредуктазы (NQO1) биоредуктивной генерации клеточного окислительного стресса. Следовательно, метиленовый синий исследуется для фотодинамического лечения рака.
ИФОСФАМИД НЕЙРОТОКСИЧЕСКИЙ
Другое, менее известное применение метиленового синего — это его применение для лечения нейротоксичности ифосфамида. Токсичный метаболит ифосфамида, хлорацетальдегид, разрушает митохондриальную дыхательную цепь, что приводит к накоплению никотинамидадениндинуклеотидного водорода (НАДН).
Метиленовый синий действует как альтернативный акцептор электронов и обращает ингибирование NADH глюконеогенеза в печени, а также ингибирует превращение хлорэтиламина в хлорацетальдегид, а также ингибирует активность многих аминоксидаз, предотвращая образование хлорацетальдегида.
Следовательно, он играет профилактическую и терапевтическую роль при индуцированной ифосфамидом энцефалопатии.
МЕТИЛЕНОВЫЙ СИНИЙ КАК КРАСИТЕЛЬ
Было обнаружено, что инфузия метиленового синего является безопасным и эффективным методом локализации аномальных паращитовидных желез.
Метиленовый синий также использовался для интраоперационной эндоскопической маркировки просвета кишечника для определения местоположения поражений.
Метиленовый синий также оказался эффективной и дешевой альтернативой красителю изосульфанового синего для локализации сигнальных лимфатических узлов у пациентов с раком молочной железы.
Метиленовый синий также использовался в диагностической микробиологии в качестве красителя. Это недорогой и быстрый метод обнаружения H.pylori.
НЕЙТРАЛИЗАЦИЯ ГЕПАРИНА
Метиленовый синий эффективно нейтрализует гепарин, особенно у пациентов с аллергией на протамины. Однако еще предстоит провести работу, чтобы определить безопасность препарата в более высоких дозах, необходимых для нейтрализации уровней гепарина, достигнутых у пациентов с шунтированием.
МЕТИЛЕНОВЫЙ СИНИЙ И ПРИАПИЗМ
Метиленовый синий использовался для лечения приапизма с высоким потоком путем внутрикавернозной инъекции, которая, как известно, противодействует эндотелиальному фактору релаксации.
МЕТИЛЕНОВЫЙ СИНИЙ И БОЛЕЗНЬ АЛЬЦГЕЙМЕРА
Связь между метиленовым синим и болезнью Альцгеймера в последнее время привлекает все большее внимание ученых. Было показано, что он ослабляет образование амилоидных бляшек и нейрофибриллярных клубков и частично восстанавливает нарушения митохондриальной функции и клеточного метаболизма.
МЕТИЛЕНОВЫЙ СИНИЙ В СОЧЕТАНИИ СО СВЕТОМ
Фотодинамическая терапия с использованием активируемого светом антимикробного агента метиленового синего убивает метициллин-резистентный золотистый стафилококк (MRSA) в поверхностных и глубоких эксцизионных ранах. Метиленовый синий в сочетании со светом также инактивирует нуклеиновую кислоту вируса гепатита С и вируса иммунодефицита человека (HIV-1) и лечит случаи резистентного бляшечного псориаза.
ПОБОЧНЫЕ ЭФФЕКТЫ
Метиленовый синий является безопасным препаратом при использовании в терапевтических дозах (<2 мг/кг). Но он может вызывать токсичность в высоких дозах. Признаками токсичности являются сердечные аритмии, коронарная вазоконстрикция, снижение сердечного выброса, почечного кровотока и мезентериального кровотока; повышение легочного сосудистого давления и легочного сосудистого сопротивления и ухудшение газообмена. Он также окрашивает мочу в зеленовато-синий цвет и придает синюшный цвет коже и слизистой оболочке, что является самоограничивающимся.
Из-за его тканевых свойств сообщалось о случае некроза кожи и жировой ткани с последующей сухой гангреной кожи у пациентки с раком молочной железы, которой была проведена биопсия сторожевого лимфатического узла с использованием перитуморальной инъекции красителя метиленового синего.
Он также может вызывать гемолитическую анемию, характеризующуюся образованием телец Хайнца, особенно у пациентов с тяжелой почечной недостаточностью и дефицитом глюкозо-6-фосфатдегидрогеназы (Г6ФД).
Новорожденные особенно подвержены неблагоприятному воздействию метиленового синего. Он вызывает гипербилирубинемию, образование мет-гемоглобина, гемолитическую анемию, респираторный дистресс, отек легких, фототоксичность и голубоватое окрашивание трахеального секрета и мочи.
Метиленовый синий также мешает световому излучению пульсоксиметра, что приводит к ложно заниженным показаниям насыщения кислородом.
Метиленовый синий из-за его свойства ингибировать моноаминоксидазу (МАО) может спровоцировать потенциально фатальную токсичность серотонина в дозах > 5 мг/кг и редко может вызвать тяжелый анафилактический шок.
ПРОТИВОПОКАЗАНИЯ
Метиленовый синий противопоказан больным с развившимися на него реакциями гиперчувствительности и при тяжелой почечной недостаточности. Он относительно противопоказан пациентам с дефицитом G6PD, так как может вызвать тяжелый гемолиз, а также пациентам с анемией с тельцами Хайнца.
ВЗАИМОДЕЙСТВИЕ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Метиленовый синий является ингибитором МАО и поэтому может взаимодействовать с селективным ингибитором обратного захвата серотонина (СИОЗС) и ингибиторами МАО, вызывая серьезную токсичность серотонина.
Он также взаимодействует с дапсоном и образует гидроксиламин, который окисляет гемоглобин, вызывая гемолиз.
ВЫВОДЫ
Метиленовый синий до сих пор был известен в основном как краситель, но теперь он входит в область кардиохирургии и интенсивной терапии в качестве очень важного терапевтического агента с разнообразными применениями. Доказательства его использования при метгемоглобинемии хорошо известны, но его использование при вазоплегии, септическом шоке, гепатопульмональном синдроме, малярии, нейротоксичности ифосфамида и т. д. ограничено, но многообещающе и требует дополнительных исследований.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://medportal.ru/mednovosti/sinka-z ... tsgeymera/
Синька замедлила развитие болезни Альцгеймера
Исследователи из Сингапура и Великобритании сообщают об успешных испытаниях лекарства от болезни Альцгеймера. По их данным, клиническое исследование препарата продемонстрировало его способность значительно снижать скорость развития нейродегенеративного заболевания. Действующим веществом лекарства является краситель метиленовый синий, более известный как синька.
Исследователи из Сингапура и Великобритании сообщают об успешных испытаниях лекарства от болезни Альцгеймера. По их данным, 50-недельное клиническое исследование препарата продемонстрировало его способность значительно сокращать скорость развития нейродегенеративного заболевания. Действующим веществом лекарства является краситель и антисептик метиленовый синий (метилтиониния хлорид), более известный как синька.
В испытаниях лекарства, проводившихся в нескольких медицинских центрах Сингапура и Великобритании, принял участие в общей сложности 321 пациент с легкой и умеренной формой болезни Альцгеймера. На протяжении исследования часть больных трижды в день принимала капсулы с метилтиониния хлоридом (30, 60 или 100 мг действующего вещества), а часть – плацебо.
Наиболее эффективной оказалась дозировка в 60 мг – скорость снижения умственных способностей у принимавших такие концентрации препарата больных сократилась на 81 процент по сравнению с группой плацебо. Разница между группами возрастала по мере продолжения исследования и к концу 50-й недели составляла 6,8 пунктов по шкале оценки болезни Альцгеймера ADAS. Кроме того, сканирование головного мозга испытуемых показало в усиление кровоснабжения пораженных болезнью зон мозга в группе получавших лекарство.
Использовавшаяся в исследовании формула метилтиониния хлорида запатентована Сингапурской компанией TauRx Therapeutics в качестве экспериментального препарата Rember.TauRx Therapeutics основана ведущим автором исследования, сотрудником Университета Абердина Клодом Вышиком (Claude Wischik). Идея использовать синьку в лечении болезни Альйгеймера пришла Вышику около 20 лет назад, когда в ходе лабораторных экспериментов он обнаружил, что это вещество способно растворять тау-протеины, скапливающиеся в тканях мозга пациентов с болезнью Альцгеймера.
Независимые наблюдатели призывают не спешить с выводами об эффективности новой терапии. Дело в том, что основной принцип этой методики основан на предположении о ведущей роли тау-протеинов в развитии болезни Альцгеймера, с которым согласны далеко не все специалисты. По альтернативной версии, причиной болезни являются другие белки – так называемые бета-амилоиды, также скапливающиеся в тканях мозга при болезни Альцгеймера. Кроме того, в настоящее время данные об успешных испытаниях «лечебной синьки» не опубликованы в рецензируемых журналах. Мало что известно и о самом новом лекарстве, которое, по словам создателей, существенно отличается от применяемых в настоящее время аналогов.
По словам доктора Вышика, публикация трех подробных отчетов о ходе клинических испытаний запланирована на ближайшие месяцы, однако перед тем как публиковать предварительные данные, ученые намерены добиться разрешения Управления по продуктам и лекарствам на проведения развернутого, третьего этапа клинических испытаний Rember’a в США.
……………………………………………………………………………………………………………………………………………………
Лечение болезни Альцгеймера: современные возможности и перспективы
https://neuronews.com.ua/ru/archive/201 ... #gsc.tab=0
Синька замедлила развитие болезни Альцгеймера
Исследователи из Сингапура и Великобритании сообщают об успешных испытаниях лекарства от болезни Альцгеймера. По их данным, клиническое исследование препарата продемонстрировало его способность значительно снижать скорость развития нейродегенеративного заболевания. Действующим веществом лекарства является краситель метиленовый синий, более известный как синька.
Исследователи из Сингапура и Великобритании сообщают об успешных испытаниях лекарства от болезни Альцгеймера. По их данным, 50-недельное клиническое исследование препарата продемонстрировало его способность значительно сокращать скорость развития нейродегенеративного заболевания. Действующим веществом лекарства является краситель и антисептик метиленовый синий (метилтиониния хлорид), более известный как синька.
В испытаниях лекарства, проводившихся в нескольких медицинских центрах Сингапура и Великобритании, принял участие в общей сложности 321 пациент с легкой и умеренной формой болезни Альцгеймера. На протяжении исследования часть больных трижды в день принимала капсулы с метилтиониния хлоридом (30, 60 или 100 мг действующего вещества), а часть – плацебо.
Наиболее эффективной оказалась дозировка в 60 мг – скорость снижения умственных способностей у принимавших такие концентрации препарата больных сократилась на 81 процент по сравнению с группой плацебо. Разница между группами возрастала по мере продолжения исследования и к концу 50-й недели составляла 6,8 пунктов по шкале оценки болезни Альцгеймера ADAS. Кроме того, сканирование головного мозга испытуемых показало в усиление кровоснабжения пораженных болезнью зон мозга в группе получавших лекарство.
Использовавшаяся в исследовании формула метилтиониния хлорида запатентована Сингапурской компанией TauRx Therapeutics в качестве экспериментального препарата Rember.TauRx Therapeutics основана ведущим автором исследования, сотрудником Университета Абердина Клодом Вышиком (Claude Wischik). Идея использовать синьку в лечении болезни Альйгеймера пришла Вышику около 20 лет назад, когда в ходе лабораторных экспериментов он обнаружил, что это вещество способно растворять тау-протеины, скапливающиеся в тканях мозга пациентов с болезнью Альцгеймера.
Независимые наблюдатели призывают не спешить с выводами об эффективности новой терапии. Дело в том, что основной принцип этой методики основан на предположении о ведущей роли тау-протеинов в развитии болезни Альцгеймера, с которым согласны далеко не все специалисты. По альтернативной версии, причиной болезни являются другие белки – так называемые бета-амилоиды, также скапливающиеся в тканях мозга при болезни Альцгеймера. Кроме того, в настоящее время данные об успешных испытаниях «лечебной синьки» не опубликованы в рецензируемых журналах. Мало что известно и о самом новом лекарстве, которое, по словам создателей, существенно отличается от применяемых в настоящее время аналогов.
По словам доктора Вышика, публикация трех подробных отчетов о ходе клинических испытаний запланирована на ближайшие месяцы, однако перед тем как публиковать предварительные данные, ученые намерены добиться разрешения Управления по продуктам и лекарствам на проведения развернутого, третьего этапа клинических испытаний Rember’a в США.
……………………………………………………………………………………………………………………………………………………
Лечение болезни Альцгеймера: современные возможности и перспективы
https://neuronews.com.ua/ru/archive/201 ... #gsc.tab=0
...
Метиленовый синий
Метиленовый синий (метилтиониния хлорид) является антиагрегантом тау-протеина [5]. При применении 60 мг метиленового синего было показано улучшение когнитивных функций во 2-й фазе клинических испытаний. Через 1 год установлено снижение прогрессирования заболевания. Лейкометилтиониний, новая композиция метиленового синего, имеет более высокую биодоступность и в настоящее время проходит 3-ю фазу испытаний [21].
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://nplus1.ru/news/2016/07/28/lmtx
Прогрессирование болезни Альцгеймера замедлили на 80 процентов
Международная группа исследователей сообщила об успехе III фазы клинических испытаний экспериментального лекарства от болезни Альцгеймера. С его помощью удалось замедлить прогрессирование деменции примерно на 80 процентов. Результаты испытаний ( http://www.multivu.com/players/English/ ... 511063.pdf ) были представлены на Международной конференции Ассоциации болезни Альцгеймера AAIC 2016 в Торонто, о них сообщает ( http://www.taurx.com/taurx-reports-firs ... %C2%AE.pdf ) также компания-разработчик TauRx Therapeutics.
В 15-месячных двойных слепых рандомизированных контролируемых испытаниях препарата LMTX приняли участие 891 пациент (62 процента женщин, средний возраст 70,6 лет) с легкой или умеренной болезнью Альцгеймера из 16 стран мира. Всем им проводили оценку функции мозга по шкале ADAS-Cog, повседневной активности по шкале ADCS-ADL, атрофии мозга по расширению латеральных желудочков на МРТ и психического статуса по шкале MMSE перед лечением и через каждые 13 недель.
85 процентов участников помимо LMTX получали назначенную ранее поддерживающую терапию имеющимися средствами умеренной эффективности. В этой группе добровольцев эффект препарата оказался невыраженным. У остальных 15 процентов монотерапия LMTX замедлила прогрессирование деменции и функциональных расстройств по соответствующим шкалам приблизительно на 80 процентов, рассказал ( https://www.newscientist.com/article/20 ... 0-per-cent ) профессор Абердинского университета и сооснователь сингапурской TauRx Therapeutics Клод Уишик (Claude Wischik), разработавший препарат. Кроме того, скорость атрофии мозга у них снизилась на 33–38 процентов по сравнению с участниками, получавшими плацебо.
По словам Уишика, природа выявленной несовместимости LMTX с существующими лекарствами пока не известна. Однако он предположил, что препараты, которые очищают мозг от образующихся при заболевании токсичных продуктов обмена, могли заодно вывести из него и LMTX.
Согласно современным представлениям, нейродегенерация при болезни Альцгеймера обусловлена накоплением в мозге двух патологических форм белков: бета-амилоида (в виде бляшек) и гиперфосфорилированного тау-белка (в виде нейрофибриллярных клубков). LMTX предотвращает образование клубков тау-белка, препятствуя его накоплению. Успех его испытаний указывает на то, что тау-белок может служить основной мишенью для терапии болезни Альцгеймера (экспериментальные препараты, затрагивающие обмен бета-амилоида, желаемого эффекта пока не продемонстрировали).
LMTX — сборное название солей лейкометилтиониния (в испытаниях применяли лейкометилтиониния бис-гидрометансульфонат — LMTM). Он представляет собой высокоочищенную стабильную безводную восстановленную форму красителя метиленового синего, который ранее применялся в качестве антисептика. Препарат относится ко второму поколению ингибиторов агрегации тау-белка (в первое входит сама метиленовая синька), разработка которых ведется уже более 30 лет.
В июне 2016 года американские исследователи сообщили ( https://nplus1.ru/news/2016/06/17/welcome-back ), что им удалось обратить снижение интеллекта у 10 пациентов с ранними стадиями болезни Альцгеймера с помощью оптимизации метаболизма по разработанному протоколу MEND.
Прогрессирование болезни Альцгеймера замедлили на 80 процентов
Международная группа исследователей сообщила об успехе III фазы клинических испытаний экспериментального лекарства от болезни Альцгеймера. С его помощью удалось замедлить прогрессирование деменции примерно на 80 процентов. Результаты испытаний ( http://www.multivu.com/players/English/ ... 511063.pdf ) были представлены на Международной конференции Ассоциации болезни Альцгеймера AAIC 2016 в Торонто, о них сообщает ( http://www.taurx.com/taurx-reports-firs ... %C2%AE.pdf ) также компания-разработчик TauRx Therapeutics.
В 15-месячных двойных слепых рандомизированных контролируемых испытаниях препарата LMTX приняли участие 891 пациент (62 процента женщин, средний возраст 70,6 лет) с легкой или умеренной болезнью Альцгеймера из 16 стран мира. Всем им проводили оценку функции мозга по шкале ADAS-Cog, повседневной активности по шкале ADCS-ADL, атрофии мозга по расширению латеральных желудочков на МРТ и психического статуса по шкале MMSE перед лечением и через каждые 13 недель.
85 процентов участников помимо LMTX получали назначенную ранее поддерживающую терапию имеющимися средствами умеренной эффективности. В этой группе добровольцев эффект препарата оказался невыраженным. У остальных 15 процентов монотерапия LMTX замедлила прогрессирование деменции и функциональных расстройств по соответствующим шкалам приблизительно на 80 процентов, рассказал ( https://www.newscientist.com/article/20 ... 0-per-cent ) профессор Абердинского университета и сооснователь сингапурской TauRx Therapeutics Клод Уишик (Claude Wischik), разработавший препарат. Кроме того, скорость атрофии мозга у них снизилась на 33–38 процентов по сравнению с участниками, получавшими плацебо.
По словам Уишика, природа выявленной несовместимости LMTX с существующими лекарствами пока не известна. Однако он предположил, что препараты, которые очищают мозг от образующихся при заболевании токсичных продуктов обмена, могли заодно вывести из него и LMTX.
Согласно современным представлениям, нейродегенерация при болезни Альцгеймера обусловлена накоплением в мозге двух патологических форм белков: бета-амилоида (в виде бляшек) и гиперфосфорилированного тау-белка (в виде нейрофибриллярных клубков). LMTX предотвращает образование клубков тау-белка, препятствуя его накоплению. Успех его испытаний указывает на то, что тау-белок может служить основной мишенью для терапии болезни Альцгеймера (экспериментальные препараты, затрагивающие обмен бета-амилоида, желаемого эффекта пока не продемонстрировали).
LMTX — сборное название солей лейкометилтиониния (в испытаниях применяли лейкометилтиониния бис-гидрометансульфонат — LMTM). Он представляет собой высокоочищенную стабильную безводную восстановленную форму красителя метиленового синего, который ранее применялся в качестве антисептика. Препарат относится ко второму поколению ингибиторов агрегации тау-белка (в первое входит сама метиленовая синька), разработка которых ведется уже более 30 лет.
В июне 2016 года американские исследователи сообщили ( https://nplus1.ru/news/2016/06/17/welcome-back ), что им удалось обратить снижение интеллекта у 10 пациентов с ранними стадиями болезни Альцгеймера с помощью оптимизации метаболизма по разработанному протоколу MEND.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
Магия метиленовой синьки
https://fis.wikireading.ru/haM7XwGWZH
....
Однако можно найти для метиленовой сини и другое применение. Она может накапливаться в головном мозге, в скоплениях таубелка, образующегося при болезни Альцгеймера. Клод Вишик, работая в Кембриджском университете, установил, что метиленовая синь не только окрашивает тау-белок, но и «распутывает» его клубок. Вишик учредил компанию TauRx, шотландскую фармацевтическую фирму, которая недавно опубликовала результаты плацебо-контролируемого испытания применения слегка измененной формы метиленовой сини, названной LMTX, для лечения болезни Альцгеймера. Через пятнадцать месяцев лечения больные, получавшие препарат, демонстрировали более медленные темпы прогрессирования, нежели больные, получавшие плацебо. В некоторых случаях удавалось добиться некоторого улучшения. Важно, что с помощью МРТ удалось подтвердить, что LTMX действительно замедляет атрофию головного мозга, характерную для болезни Альцгеймера. Интересно, что LTMX не проявляет действие на фоне приема других лекарств, которыми лечат болезнь Альцгеймера, вероятно из-за того, что прием других лекарств вызывает быстрое выведение LTMX из крови.
По эту сторону океана, в Техасском университете, в ходе небольшого по масштабу плацебо-контролируемого исследования было обнаружено улучшение памяти у тринадцати здоровых взрослых испытуемых. Кроме того, с помощью функциональной МРТ было показано, что метиленовая синь может значительно повышать активность участков головного мозга, отвечающих за память. Если это синтетическое соединение действительно окажется стимулятором памяти и средством лечения болезни Альцгеймера, то в красочную историю метиленовой сини будет вписана еще одна яркая глава.
https://fis.wikireading.ru/haM7XwGWZH
....
Однако можно найти для метиленовой сини и другое применение. Она может накапливаться в головном мозге, в скоплениях таубелка, образующегося при болезни Альцгеймера. Клод Вишик, работая в Кембриджском университете, установил, что метиленовая синь не только окрашивает тау-белок, но и «распутывает» его клубок. Вишик учредил компанию TauRx, шотландскую фармацевтическую фирму, которая недавно опубликовала результаты плацебо-контролируемого испытания применения слегка измененной формы метиленовой сини, названной LMTX, для лечения болезни Альцгеймера. Через пятнадцать месяцев лечения больные, получавшие препарат, демонстрировали более медленные темпы прогрессирования, нежели больные, получавшие плацебо. В некоторых случаях удавалось добиться некоторого улучшения. Важно, что с помощью МРТ удалось подтвердить, что LTMX действительно замедляет атрофию головного мозга, характерную для болезни Альцгеймера. Интересно, что LTMX не проявляет действие на фоне приема других лекарств, которыми лечат болезнь Альцгеймера, вероятно из-за того, что прием других лекарств вызывает быстрое выведение LTMX из крови.
По эту сторону океана, в Техасском университете, в ходе небольшого по масштабу плацебо-контролируемого исследования было обнаружено улучшение памяти у тринадцати здоровых взрослых испытуемых. Кроме того, с помощью функциональной МРТ было показано, что метиленовая синь может значительно повышать активность участков головного мозга, отвечающих за память. Если это синтетическое соединение действительно окажется стимулятором памяти и средством лечения болезни Альцгеймера, то в красочную историю метиленовой сини будет вписана еще одна яркая глава.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
Метиленовый синий, или «синька» моей бабушки, возможно, является эффективным средством профилактики и лечения COVID-19
https://koreans.kz/news/metilenovyy-sin ... effek.html
Мы уже писали о таких препаратах с недоказанной эффективностью, как гидроксихлорохин, фавипиравир, ивермектин и др., которые, тем не менее, широко применяются по всему миру для лечения COVID-19, хотя имеют ряд серьезных побочных эффектов. И вдруг приходит новость о том, что метиленовый синий краситель, который в народе известен как «синька», может убивать вирус и восстанавливать многие функции организма.
Об открытии сообщили ученые Первого Московского государственного медицинского университета им. И. М. Сеченова, что свидетельствует о высоком уровне проведенного исследования.
Хотя метиленовый синий известен с 1877 года как краситель в промышленности, впоследствии он перешел в разряд медикаментов, так как у него был обнаружен ряд лечебных свойств:
- обладает мощным антиоксидантным и противовоспалительным действием;
- эффективен против всех видов малярии;
- успешно применялся для лечения инфекций мочевыводящих путей и сепсиса, а также для лечения психозов, деменции и болезни Альцгеймера;
- входит в список жизненно важных лекарств ВОЗ как антидот при отравлениях цианидами, угарным газом и сероводородом;
- обладает значительным противовирусным эффектом (доказано инактивировал вирус Эбола и коронавирус MERS-CoV, вызывающий ближневосточный респираторный синдром, в плазме крови).
В последние годы метиленовый синий применяется как фотосенсибилизатор в фотодинамической терапии, направленной на разрушение раковых клеток. Под воздействием света с определенной длиной волны он химически активирует кислород, который быстро разрушает белки и другие структуры раковых клеток в зоне облучения, что сравнимо по действию с радиоактивным излучением.
Идея использовать метиленовый синий для лечения COVID-19 родилась под влиянием публикации китайских ученых, которые показали, что при воздействии раствора данного вещества вирус в плазме крови погибал в течение считанных минут, а после дополнительного облучения красным светом практически моментально.
Методика лечения COVID-19 путем приема внутрь метиленового синего в сочетании с фотодинамической терапией на зону носоглотки и груди была разработана и апробирована в Институте кластерной онкологии им. Л. Л. Левшина, базирующегося в клинике Первого Московского государственного медицинского университета им. И. М. Сеченова. Она показала очень хорошие результаты в клинике: все больные COVID-19 выздоровели. Можно утверждать, что метод успешно прошел первую фазу клинических испытаний и сейчас необходимы дальнейшие исследования.
Кстати, метиленовым синим заинтересовались не только российские медики. Недавно были опубликованы результаты любопытного наблюдения за 2,5 тысячи французских больных раком, которые принимали метиленовый синий в период пандемии для лечения своего основного заболевания. Хотя в их семьях наблюдалось немало случаев заболевания коронавирусом, никто из этих пациентов не заболел.
Директор вышеупомянутого института академик РАН Игорь Решетов считает, что у метиленового синего имеется универсальный механизм уничтожения коронавирусов и других респираторных вирусов, для изучения которого необходимы дальнейшие полномасштабные исследования, поэтому давать какие-либо рекомендации рано.
Однако меня больше заинтересовала группа добровольцев с высоким риском заражения, которая состояла в основном из врачей, работавших в «красных зонах» и самих исследователей. Все добровольцы принимали внутрь метиленовый синий, разведенный в воде, один раз в неделю для профилактики заражения. Кстати, никто из них не заболел и ни у кого из добровольцев и больных не наблюдалось никаких побочных эффектов.
Я взяла на себя смелость списать рекомендации из инструкции по применению метиленового синего, с учетом того, что данный препарат в данной дозе абсолютно безопасен для взрослых. Нельзя применять его при аллергии на сам препарат, беременным и кормящим, а также постоянно принимающим антидепрессанты и детям до 12 лет.
Метиленовый синий продается в аптеке без рецепта в виде флаконов, содержащих 25 мл 1-процентрого раствора. В Москве его уже раскупили, в других местах можно найти.
Раствор готовится из расчета: 1 мл 1-процентного раствора на 10 кг веса, разводится в 200 г воды комнатной температуры. Должно получиться 1 мг на 1 кг веса тела. Принимается внутрь один раз в 7 дней в период пандемии, а при близком контакте с заболевшими – один раз в 4 дня после еды через 20-30 минут.
При первых признаках коронавирусной инфекции можно пить этот раствор 1 раз в день в течение 3 дней, но не больше! Все симптомы быстро уходят.
Доктор Евдокименко рекомендует упрощенную «народную» методику: 5-10 капель 1-процентного водного р-ра метиленового синего растворить в стакане воды и пить медленно 1 раз в день после еды, из расчета 1 капля на 1 кг веса. При весе 50 кг – 5 капель, далее по возрастанию веса. Для профилактики коронавирусной инфекции и гриппа пить такой раствор 1 раз в 7 дней.
Предупреждение! Эти рекомендации носят неофициальный характер и базируются на данных предварительного исследования, проведенного в клинике Первого Московского ГМУ им И. М. Сеченова. Многолетнее использование данного препарата в практической медицине доказало его полную безопасность при использовании в терапевтических дозах, но рекомендуется при лечении любым экспериментальным препаратом предварительно консультироваться со своим лечащим врачом.
https://koreans.kz/news/metilenovyy-sin ... effek.html
Мы уже писали о таких препаратах с недоказанной эффективностью, как гидроксихлорохин, фавипиравир, ивермектин и др., которые, тем не менее, широко применяются по всему миру для лечения COVID-19, хотя имеют ряд серьезных побочных эффектов. И вдруг приходит новость о том, что метиленовый синий краситель, который в народе известен как «синька», может убивать вирус и восстанавливать многие функции организма.
Об открытии сообщили ученые Первого Московского государственного медицинского университета им. И. М. Сеченова, что свидетельствует о высоком уровне проведенного исследования.
Хотя метиленовый синий известен с 1877 года как краситель в промышленности, впоследствии он перешел в разряд медикаментов, так как у него был обнаружен ряд лечебных свойств:
- обладает мощным антиоксидантным и противовоспалительным действием;
- эффективен против всех видов малярии;
- успешно применялся для лечения инфекций мочевыводящих путей и сепсиса, а также для лечения психозов, деменции и болезни Альцгеймера;
- входит в список жизненно важных лекарств ВОЗ как антидот при отравлениях цианидами, угарным газом и сероводородом;
- обладает значительным противовирусным эффектом (доказано инактивировал вирус Эбола и коронавирус MERS-CoV, вызывающий ближневосточный респираторный синдром, в плазме крови).
В последние годы метиленовый синий применяется как фотосенсибилизатор в фотодинамической терапии, направленной на разрушение раковых клеток. Под воздействием света с определенной длиной волны он химически активирует кислород, который быстро разрушает белки и другие структуры раковых клеток в зоне облучения, что сравнимо по действию с радиоактивным излучением.
Идея использовать метиленовый синий для лечения COVID-19 родилась под влиянием публикации китайских ученых, которые показали, что при воздействии раствора данного вещества вирус в плазме крови погибал в течение считанных минут, а после дополнительного облучения красным светом практически моментально.
Методика лечения COVID-19 путем приема внутрь метиленового синего в сочетании с фотодинамической терапией на зону носоглотки и груди была разработана и апробирована в Институте кластерной онкологии им. Л. Л. Левшина, базирующегося в клинике Первого Московского государственного медицинского университета им. И. М. Сеченова. Она показала очень хорошие результаты в клинике: все больные COVID-19 выздоровели. Можно утверждать, что метод успешно прошел первую фазу клинических испытаний и сейчас необходимы дальнейшие исследования.
Кстати, метиленовым синим заинтересовались не только российские медики. Недавно были опубликованы результаты любопытного наблюдения за 2,5 тысячи французских больных раком, которые принимали метиленовый синий в период пандемии для лечения своего основного заболевания. Хотя в их семьях наблюдалось немало случаев заболевания коронавирусом, никто из этих пациентов не заболел.
Директор вышеупомянутого института академик РАН Игорь Решетов считает, что у метиленового синего имеется универсальный механизм уничтожения коронавирусов и других респираторных вирусов, для изучения которого необходимы дальнейшие полномасштабные исследования, поэтому давать какие-либо рекомендации рано.
Однако меня больше заинтересовала группа добровольцев с высоким риском заражения, которая состояла в основном из врачей, работавших в «красных зонах» и самих исследователей. Все добровольцы принимали внутрь метиленовый синий, разведенный в воде, один раз в неделю для профилактики заражения. Кстати, никто из них не заболел и ни у кого из добровольцев и больных не наблюдалось никаких побочных эффектов.
Я взяла на себя смелость списать рекомендации из инструкции по применению метиленового синего, с учетом того, что данный препарат в данной дозе абсолютно безопасен для взрослых. Нельзя применять его при аллергии на сам препарат, беременным и кормящим, а также постоянно принимающим антидепрессанты и детям до 12 лет.
Метиленовый синий продается в аптеке без рецепта в виде флаконов, содержащих 25 мл 1-процентрого раствора. В Москве его уже раскупили, в других местах можно найти.
Раствор готовится из расчета: 1 мл 1-процентного раствора на 10 кг веса, разводится в 200 г воды комнатной температуры. Должно получиться 1 мг на 1 кг веса тела. Принимается внутрь один раз в 7 дней в период пандемии, а при близком контакте с заболевшими – один раз в 4 дня после еды через 20-30 минут.
При первых признаках коронавирусной инфекции можно пить этот раствор 1 раз в день в течение 3 дней, но не больше! Все симптомы быстро уходят.
Доктор Евдокименко рекомендует упрощенную «народную» методику: 5-10 капель 1-процентного водного р-ра метиленового синего растворить в стакане воды и пить медленно 1 раз в день после еды, из расчета 1 капля на 1 кг веса. При весе 50 кг – 5 капель, далее по возрастанию веса. Для профилактики коронавирусной инфекции и гриппа пить такой раствор 1 раз в 7 дней.
Предупреждение! Эти рекомендации носят неофициальный характер и базируются на данных предварительного исследования, проведенного в клинике Первого Московского ГМУ им И. М. Сеченова. Многолетнее использование данного препарата в практической медицине доказало его полную безопасность при использовании в терапевтических дозах, но рекомендуется при лечении любым экспериментальным препаратом предварительно консультироваться со своим лечащим врачом.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://europepmc.org/article/cba/518857
Inactivation of SARS coronavirus in human plasma by methylene blue/light method
(декабрь 2004)
Инактивация коронавируса SARS в плазме человека методом метиленового синего/света
Абстракт
SARS-CoV был выделен из сыворотки больного SARS и воспроизведен клеточной линией VeroE6. После добавления к плазме человека, которая содержала различные концентрации метиленового синего, SARS-CoV обрабатывали метиленовым синим/светом в течение различных периодов времени, а затем брали образец плазмы для инокуляции клеточной линии для анализа цитопатического эффекта. Для инактивации SARS-CoV (6,5 lgTCID_(50)/мл) в плазме, подвергнутой воздействию видимого света (40000 лк) в присутствии 1 мкмоль/л метиленового синего, требовалось около 30 минут, и всего 3 минуты. были необходимы для инактивации выше титра вирусов, если концентрация метиленового синего повышалась до 5 мкмоль/л.
Inactivation of SARS coronavirus in human plasma by methylene blue/light method
(декабрь 2004)
Инактивация коронавируса SARS в плазме человека методом метиленового синего/света
Абстракт
SARS-CoV был выделен из сыворотки больного SARS и воспроизведен клеточной линией VeroE6. После добавления к плазме человека, которая содержала различные концентрации метиленового синего, SARS-CoV обрабатывали метиленовым синим/светом в течение различных периодов времени, а затем брали образец плазмы для инокуляции клеточной линии для анализа цитопатического эффекта. Для инактивации SARS-CoV (6,5 lgTCID_(50)/мл) в плазме, подвергнутой воздействию видимого света (40000 лк) в присутствии 1 мкмоль/л метиленового синего, требовалось около 30 минут, и всего 3 минуты. были необходимы для инактивации выше титра вирусов, если концентрация метиленового синего повышалась до 5 мкмоль/л.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://nplus1.ru/news/2017/06/02/methylene-blue-skin
Синий краситель оказался способен омолаживать кожу
Ученые из Мэрилендского университета выяснили, что метиленовый синий может служить эффективным средством для омолаживания кожи. Обработка фибробластов этим красителем вызвала повышение пролиферации и жизнеспособности этих клеток, ускоряла заживление ран, а также увеличивала увлажненность кожи и плотность ее дермального слоя. Исследование опубликовано в Scientific Reports.
Оксидативный стресс — один из главных факторов старения кожи. Результат такого стресса — повышенное содержание активных форм кислорода (АФК). Оно приводит, в частности, к расщеплению коллагена, вызывает появление морщин и пигментации кожи, а также снижает ее способность к заживлению ран. В природе повышенное содержание АФК в клетках связано, во-первых, с естественным старением организма, а во-вторых, с воздействием на организм ионизирующего излучения или загрязненного воздуха. Антиоксиданты, снижающие последствия оксидативного стресса, широко применяются в косметической индустрии. Они снижают выработку и нейтрализуют уже имеющиеся АФК в фибробластах кожи человека.
Метиленовый синий (МС) впервые был синтезирован Генрихом Каро в 1876 году. Он используется как краситель, в том числе — в аналитической химии, позволяя определять наличие примесей хлоратов, магния, кальция и других соединений; кроме того, он используется в качестве антисептика и антидота. Также он является эффективным антиоксидантом.
Ученые работали с культурами фибробластов кожи человека, взятых у здорового человека среднего возраста и у человека с синдромом прогении Хатчинсона-Гилфорда — генетическим заболеванием, вызывающим преждевременно старение. Действие МС сравнивали с действием других антиоксидантов, часто использующихся в целях замедления старения (N-ацетил-L-цистеином, MitoQ — модифицированным коэнзимом Q-10 и MitoTEMPO — агонистом супероксиддисмутазы). Клетки обрабатывали этими антиоксидантами в течение четырех недель. Выяснилось, что МС наиболее эффективно снижает уровень АФК в митохондриях.
Интересно, что MitoQ в рамках данного исследования показал не положительные, а резко отрицательные результаты — он увеличивал число АФК в митохондриях и замедлял пролиферацию как больных, так и здоровых фибробластов. N-ацетил-L-цистеин также практически не оказывал влияния на АФК в этом долговременном эксперименте и замедлял пролиферацию клеток. MitoTEMPO несколько снижал уровень АФК у клеток здорового человека, но не оказывал воздействия на фибробласты больного.
Ученые создали трехмерную модель кожи человека в лабораторных условиях и провели «тест на раздражительность» для МС. Его результаты показали, что МС, по-видимому, не вреден при долгосрочном применении и не оказывает какого-либо отрицательного воздействия на кожу. Напротив, он увеличивал жизнеспособность ее клеток, ускорял заживление ран, способствовал повышению увлажненности кожи и плотности дермального слоя. По-видимому, он оказывает влияние на липидный состав рогового слоя эпидермиса.
Обрабока МС клеточных линий от людей разного возраста показала, что этот препарат способен снижать в фибробластах 80-летнего человека уровень АФК и сигналов, характерных для сенесцентных клеток (SA-β-gal и p16), и доводить их до уровня клеток людей моложе 30 лет. МС стимулировал пролиферацию фибробластов и замедлял процессы их старения.
Анализ экспрессии генов показал, что МС меняет характер работы ряда генов, имеющих отношение к внеклеточному матриксу кожи, в том числе повышает выработку эластина и коллагена 2A1. Кроме того, он усиливает синтез транскрипционного фактора Nrf2 и, соответственно, синтез регулируемых им белков, имеющих антиоксидантные свойства.
Следующим этапом является разработка косметических средств на основе метиленового синего, к которой исследователи уже приступили. Раньше мы рассказывали, что его восстановленная форма также показывает хорошие результаты в качестве лекарственного средства для борьбы с болезнью Альцгеймера.
Синий краситель оказался способен омолаживать кожу
Ученые из Мэрилендского университета выяснили, что метиленовый синий может служить эффективным средством для омолаживания кожи. Обработка фибробластов этим красителем вызвала повышение пролиферации и жизнеспособности этих клеток, ускоряла заживление ран, а также увеличивала увлажненность кожи и плотность ее дермального слоя. Исследование опубликовано в Scientific Reports.
Оксидативный стресс — один из главных факторов старения кожи. Результат такого стресса — повышенное содержание активных форм кислорода (АФК). Оно приводит, в частности, к расщеплению коллагена, вызывает появление морщин и пигментации кожи, а также снижает ее способность к заживлению ран. В природе повышенное содержание АФК в клетках связано, во-первых, с естественным старением организма, а во-вторых, с воздействием на организм ионизирующего излучения или загрязненного воздуха. Антиоксиданты, снижающие последствия оксидативного стресса, широко применяются в косметической индустрии. Они снижают выработку и нейтрализуют уже имеющиеся АФК в фибробластах кожи человека.
Метиленовый синий (МС) впервые был синтезирован Генрихом Каро в 1876 году. Он используется как краситель, в том числе — в аналитической химии, позволяя определять наличие примесей хлоратов, магния, кальция и других соединений; кроме того, он используется в качестве антисептика и антидота. Также он является эффективным антиоксидантом.
Ученые работали с культурами фибробластов кожи человека, взятых у здорового человека среднего возраста и у человека с синдромом прогении Хатчинсона-Гилфорда — генетическим заболеванием, вызывающим преждевременно старение. Действие МС сравнивали с действием других антиоксидантов, часто использующихся в целях замедления старения (N-ацетил-L-цистеином, MitoQ — модифицированным коэнзимом Q-10 и MitoTEMPO — агонистом супероксиддисмутазы). Клетки обрабатывали этими антиоксидантами в течение четырех недель. Выяснилось, что МС наиболее эффективно снижает уровень АФК в митохондриях.
Интересно, что MitoQ в рамках данного исследования показал не положительные, а резко отрицательные результаты — он увеличивал число АФК в митохондриях и замедлял пролиферацию как больных, так и здоровых фибробластов. N-ацетил-L-цистеин также практически не оказывал влияния на АФК в этом долговременном эксперименте и замедлял пролиферацию клеток. MitoTEMPO несколько снижал уровень АФК у клеток здорового человека, но не оказывал воздействия на фибробласты больного.
Ученые создали трехмерную модель кожи человека в лабораторных условиях и провели «тест на раздражительность» для МС. Его результаты показали, что МС, по-видимому, не вреден при долгосрочном применении и не оказывает какого-либо отрицательного воздействия на кожу. Напротив, он увеличивал жизнеспособность ее клеток, ускорял заживление ран, способствовал повышению увлажненности кожи и плотности дермального слоя. По-видимому, он оказывает влияние на липидный состав рогового слоя эпидермиса.
Обрабока МС клеточных линий от людей разного возраста показала, что этот препарат способен снижать в фибробластах 80-летнего человека уровень АФК и сигналов, характерных для сенесцентных клеток (SA-β-gal и p16), и доводить их до уровня клеток людей моложе 30 лет. МС стимулировал пролиферацию фибробластов и замедлял процессы их старения.
Анализ экспрессии генов показал, что МС меняет характер работы ряда генов, имеющих отношение к внеклеточному матриксу кожи, в том числе повышает выработку эластина и коллагена 2A1. Кроме того, он усиливает синтез транскрипционного фактора Nrf2 и, соответственно, синтез регулируемых им белков, имеющих антиоксидантные свойства.
Следующим этапом является разработка косметических средств на основе метиленового синего, к которой исследователи уже приступили. Раньше мы рассказывали, что его восстановленная форма также показывает хорошие результаты в качестве лекарственного средства для борьбы с болезнью Альцгеймера.
-

Елена25 - Богиня Муми-Дола
- Сообщения: 10494
- Зарегистрирован: Ср 23 сен 2009, 23:21
- Откуда: Москва
Re: Метиленовый синий (синька)
https://www.nature.com/articles/s41598-017-02419-3
Anti-Aging Potentials of Methylene Blue for Human Skin Longevity
(май 2017)
Антивозрастной потенциал метиленового синего для продления жизни кожи человека
Абстракт
Окислительный стресс является основной причиной старения кожи, которое включает морщины, пигментацию и ослабленную способность к заживлению ран. Применение антиоксидантов в уходе за кожей хорошо зарекомендовало себя как эффективный подход к замедлению процесса старения кожи. Метиленовый синий (МС), традиционный антиоксидант, нацеленный на митохондрии, продемонстрировал высокую эффективность очистки от АФК в культивируемых фибробластах кожи человека, полученных от здоровых доноров и от пациентов с прогерией, генетическим заболеванием преждевременного старения. По сравнению с другими широко используемыми антиоксидантами общего и митохондриального действия мы обнаружили, что MС более эффективно стимулирует пролиферацию фибробластов кожи и замедляет клеточное старение. Тест на раздражение кожи, проведенный на трехмерной модели кожи человека, реконструированной in vitro, показал, что MС безопасен при длительном использовании и не вызывает раздражения даже при высоких концентрациях. Применение MB к этой 3D-модели кожи также продемонстрировало, что MС улучшает жизнеспособность кожи, способствует заживлению ран и увеличивает гидратацию кожи и толщину дермы. Анализ экспрессии генов показал, что лечение MС изменяет экспрессию подмножества белков внеклеточного матрикса в коже, включая активацию эластина и коллагена 2A1, двух основных компонентов здоровой кожи. В целом, наше исследование показывает, что MС обладает большим потенциалом для ухода за кожей.
Введение
Кожа – самый большой и самый видимый орган человеческого тела. Старая кожа биологически характеризуется уплощением дермально-эпидермального соединения и общей атрофией внеклеточного матрикса (ECM) с дезорганизованным и сниженным содержанием коллагена и эластина1, 2. Существует два различных типа старения кожи, внутреннее и внешнее, вызванное физиологические и экологические факторы соответственно1,2,3. Внутреннее старение кожи отражает естественные изменения кожи по мере старения и клинически проявляется в виде мелких морщин на сухой коже. Внешнее старение кожи представляет собой ускоренную форму из-за воздействия на кожу солнечного света и/или загрязнения воздуха и фенотипически проявляется в виде сухой, грубой, пигментированной и истертой кожи, особенно на лице и руках. Хотя оба типа старения кожи проявляются по-разному, они частично связаны с окислительным повреждением, вызванным свободными радикалами.
Уравновешивая производство свободных радикалов и нейтрализацию антиоксидантов, клетки обычно поддерживают низкие уровни активных форм кислорода (АФК)4. По мере старения сочетание накопления АФК и снижения способности поглощать АФК приводит к усилению окислительного стресса, что приводит к повреждению макромолекул в органах. Когда кожа регулярно подвергается стрессовым факторам окружающей среды, таким как УФ-излучение, дым и загрязняющие вещества, вырабатывается повышенное количество свободных радикалов, которые ускоряют старение кожи2. Избыток АФК снижает синтез коллагена и увеличивает расщепление коллагена за счет стимуляции экспрессии матриксной металлопротеиназы (ММП), что в конечном итоге вызывает изменения дермального матрикса5, 6. На основании этой теории АФК, эффективным подходом к замедлению старения кожи является внешнее питание. антиоксиданты через продукты по уходу за кожей, чтобы либо подавить производство, либо нейтрализовать избыток свободных радикалов6.
Метиленовый синий (МС), лекарство вековой давности, впервые синтезированное в 1876 году, использовалось в клинической медицине для лечения различных заболеваний, в т.ч. метгемоглобинемия, малярия, вазоплегия, септический шок, химиотерапия рака и болезнь Альцгеймера7,8,9. MС представляет собой диаминофенотиазин с низким окислительно-восстановительным потенциалом 11 мВ. Это свойство обеспечивает эффективную цикличность между окисленной формой MС и восстановленной формой MСH2, что облегчает транспорт электронов в митохондриях и снижает выработку митохондриального супероксида. Он также индуцирует экспрессию митохондриальных комплексов II и IV9, 10. Кроме того, MС обладает высокой проницаемостью в биологических мембранах из-за его растворимости как в воде, так и в органическом растворителе, что позволяет ему свободно проникать во внутриклеточные компартменты, такие как митохондрии, лизосомы и ядро10. ,11,12.
Недавно MС привлек внимание не только своим нейропротекторным действием при лечении болезни Альцгеймера7, 9, но и своими омолаживающими свойствами10, 13, 14. Предыдущие исследования показали, что при лечении MС нормальные фибробласты демонстрируют увеличение продолжительности жизни клеток, улучшение клеточной пролиферации и сниженной экспрессии p16, биомаркера физиологического старения9, 10. Кроме того, MС увеличивал продолжительность жизни самок мышей на 6% при включении в пищу14. Недавно мы показали, что MС в наномолярной концентрации восстанавливает аномальные ядерные и митохондриальные фенотипы, стимулирует пролиферацию клеток и замедляет старение фибробластов кожи у пациентов с синдромом прогерии Хатчинсона-Гилфорда (HGPS, прогерия), редким генетическим заболеванием ускоренного старения13.
Основываясь на этих наблюдениях, мы предполагаем, что MС может эффективно защищать кожу от окислительного стресса и замедлять старение кожи. Чтобы проверить эту идею, мы исследовали омолаживающие эффекты MС в коже человека, используя 2D первичные дермальные фибробласты и реконструировали 3D модели кожи человека.
Полученные результаты
MС является более мощным поглотителем АФК, чем NAC, MitoQ и mTEM.
Чтобы оценить эффективность MС в качестве антиоксиданта, мы сначала сравнили эффекты лечения MС с эффектами трех других популярных поглотителей АФК, в частности, N-ацетил-L-цистеина (NAC), MitoQ и MitoTEMPO (mTEM). (Дополнительные таблицы 1 и 2). NAC является широко используемым общим поглотителем АФК, который действует как предшественник синтеза глутатиона и стимулирует определенные ферменты, участвующие в регенерации глутатиона15. MitoQ представляет собой модифицированный кофермент Q10 с избирательным накоплением в митохондриях16. mTEM представляет собой митохондриально-направленный миметик супероксиддисмутазы, который обладает свойствами удаления супероксида и алкильных радикалов17, 18. Чтобы оценить эффекты каждого антиоксиданта, первичные фибробласты кожи нормального человека среднего возраста и пациента с HGPS лечили в течение 4 недель. Митохондриальные АФК (обозначенные MitoSOX), основной ресурс всех клеточных АФК, затем измеряли с помощью анализа FACS. Клетки HGPS использовались в качестве ускоренной модели нормального старения, поскольку они имеют много общих черт с физиологическим старением19 (дополнительные таблицы 1 и 2).
NAC добавляли в культуральную среду в концентрации 100 мкМ в соответствии с предыдущей публикацией20. В отличие от омолаживающих эффектов MB, длительное лечение NAC не снижало уровень митохондриальных АФК и, по-видимому, замедляло пролиферацию клеток как в нормальных, так и в HGPS-клетках (рис. 1A и B). К нашему удивлению, лечение MitoQ в дозе 100 нМ, как предполагалось в предыдущих исследованиях 16, 21, не снижало, а резко повышало уровень митохондриальных АФК (рис. 1С). Кроме того, обработка MitoQ не способствовала, а ингибировала пролиферацию клеток как в нормальных, так и в HGPS-клетках (рис. 1D). Обработка mTEM при концентрации 100 нМ показала умеренные эффекты удаления АФК на клетках HGPS (рис. 1E). Он также умеренно способствовал нормальной пролиферации клеток, но не стимулировал клетки HGPS (рис. 1F). Среди всех четырех протестированных антиоксидантов MС был наиболее эффективным в снижении митохондриальных АФК и стимулировании пролиферации клеток кожи (рис. 1A–F, дополнительная таблица 2).
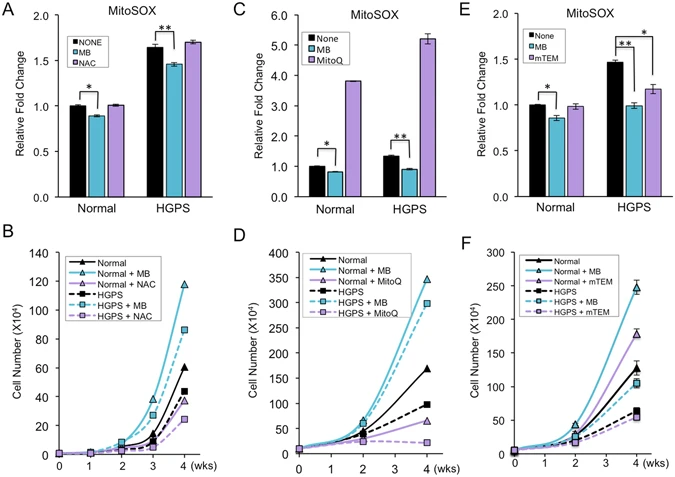
МС уменьшает признаки старения в старых клетках кожи
Затем мы спросили, может ли лечение MС задержать или обратить вспять фенотипы старения из клеток кожи, полученных от пожилых людей. Две старые линии дермальных фибробластов от лиц старше 80 лет (3-OM и 4-OF) и две молодые линии фибробластов кожи от лиц моложе 30 лет (1-YM и 2-YF) были отобраны для лечения MС (дополнительная таблица 1). ). Старые фибробласты, особенно клетки 4-OF, демонстрировали тяжелые фенотипы старения. На молекулярном уровне линии 3-OM и 4-OF демонстрировали повышенные сигналы SA-β-gal и экспрессию p16, двух широко используемых биомаркеров старения, по сравнению с таковыми в молодых клетках (1-YM и 2-YF) (рис. 2А и В). Анализ FACS выявил гораздо более высокие уровни митохондриальных АФК в 3-OM и 4-OF, чем в контрольных клетках 1-YM и 2-YF (рис. 2C). Кроме того, старые клетки пролиферировали намного медленнее, чем молодые клетки (рис. 2D, сплошные линии). В частности, клетки 4-OF прекратили рост к концу эксперимента на 18-м пассаже (рис. 2D).
После выращивания клеток в культуральной среде с добавлением 100 нМ MС в течение четырех недель стало очевидно, что связанные со старением фенотипы значительно уменьшились в старых клеточных линиях 3-OM и 4-OF. Обработка MС эффективно снижала сигналы SA-β-gal и снижала экспрессию p16 в клетках 3-OM и 4-OF (рис. 2A и B). Кроме того, обработка MС снижала повышенный уровень MitoSOX в старых клеточных линиях, особенно в линии 3-OM, до уровня, сравнимого с таковым в молодых клетках (рис. 2C). Кроме того, анализ кривой роста показал, что все клеточные линии (как молодые, так и старые) лучше пролиферировали в клеточной среде с добавлением MС (пунктирные линии, рис. 2D). В совокупности эти результаты показали, что лечение MС способно уменьшать и/или обращать вспять фенотипы старения в старых фибробластах кожи.
MС повышает экспрессию Nrf2 и нижестоящих антиоксидантных генов.
Ядерный фактор, связанный с эритроидом 2, фактор 2 (Nrf2), известен как важный регулятор системы антиоксидантной защиты, индуцирующий экспрессию множества генов, содержащих элементы антиоксидантного ответа (ARE), тем самым снижая общий клеточный ROS22. Недавнее исследование показало, что антиоксидантный путь Nrf2 является движущим механизмом HGPS23. Важно отметить, что МС, как было показано, активирует Nrf2 в нейронах24.
Мы предполагаем, что MС может активировать опосредованный Nrf2 антиоксидантный ответ, тем самым моделируя тушение АФК в фибробластах кожи. Чтобы проверить эту идею, мы сначала изучили экспрессию Nrf2 во всех шести линиях дермальных фибробластов человека, использованных в исследованиях рис. 1 и 2. Вестерн-блоттинг подтвердил повышенное количество белка Nrf2 в большинстве клеточных линий, обработанных MB, по сравнению с контрольным носителем (рис. 3А и В). Старая клетка 3-OM не показала явного увеличения белка Nrf2 при обработке MB, вероятно, из-за ее крайней стадии старения клеток, что ограничивает количество клеток для анализа. Затем мы исследовали уровни мРНК генов, содержащих ARE, расположенных ниже по течению Nrf2, в линии фибробластов HGPS, где наблюдалось наиболее значительное увеличение белка Nrf2 при обработке MС. Количественный анализ RT-PCR выявил значительное увеличение экспрессии мРНК подмножества ARE-содержащих генов, включая GCLC, GSR, GPX7, GSTM1 и TBP (рис. 3C). Вместе эти анализы подтверждают идею о том, что MС регулирует клеточные уровни ROS, по крайней мере частично, путем активации Nrf2-опосредованного антиоксидантного ответа.
MС повышает жизнеспособность тканей и не вызывает раздражения на реконструированной in vitro трехмерной коже человека.
Основываясь на потенциале MС как мощного антиоксиданта в 2D-линиях фибробластов, мы затем исследовали влияние MС на 3D-реконструкцию эпидермиса кожи человека. Мы использовали две доступные модели кожи: модель кожи EpiDerm EPI-200 (рис. 4A, верхняя панель) и модель кожи полной толщины EpiDerm EFT-412 (рис. 4A, нижняя панель). Эти модели кожи in vitro состоят из нормальных эпидермальных кератиноцитов и фибробластов человеческого происхождения, культивируемых на поверхности раздела воздух-жидкость на полупроницаемой вставке для тканевых культур (рис. 4B, подробности описаны в разделе «Материалы и методы»), которые имитируют нормальный эпидермис кожи человека и используются в качестве одобренной замены кроликов Дрейза для теста на раздражение кожи in vitro (SIT)18.
Во-первых, мы оценили безопасность МБ, проведя SIT на модели EPI-200. Раздражение кожи характеризуется обратимой местной воспалительной реакцией, и анализ жизнеспособности клеток МТТ используется для оценки повреждения, вызванного исследуемым раздражителем. Снижение МТТ более чем на 50% указывало на раздражение кожи, как показано в положительном контроле (5% SDS, рис. 4C). МБ тестировали в широком диапазоне концентраций от 0,2 мкМ до 500 мкМ. Ни одна из этих дозировок существенно не влияла на жизнеспособность клеток при местном воздействии в течение 60 минут (рис. 4С).
Чтобы дополнительно проверить потенциальное раздражение MB после длительного применения на коже, мы добавили MB в различных концентрациях в культуральную среду и инкубировали полнослойную модель кожи EFT-412 в этих средах в общей сложности в течение двух недель. На 14-й день проводили анализ МТТ. В течение этого двухнедельного инкубационного периода мы заметили, что ткани кожи, обработанные высокими концентрациями MB (5,0 мкМ и выше), начали казаться синими через 3 дня, что позволяет предположить, что дозировка MB должна быть ограничена, чтобы избежать его побочного окрашивающего эффекта на внешний вид кожи. . В тканях, обработанных более низкими концентрациями MB (от 0,1 мкМ до 2,5 мкМ), не было никакого окрашивания тканей. В соответствии со способностью MB стимулировать пролиферацию клеток, мы заметили, что в дозе 0,5 мкМ MB значительно увеличивает жизнеспособность клеток по сравнению с контролем PBS. Кроме того, ткани, обработанные более высокими концентрациями MB (5,0 мкМ и 10,0 мкМ), показали снижение жизнеспособности клеток (рис. 4D). На основании этих результатов можно сделать вывод, что низкие концентрации МС (менее 2,5 мкМ) не раздражают и не окрашивают кожу и поэтому безопасны для длительного использования. В результате мы провели последующие исследования с MB в концентрациях ниже 2,5 мкМ.
MС увеличивает толщину кожи и увлажнение
Толщина кожи человека уменьшается в среднем на 6% за десятилетие25. Постепенно истончающаяся с возрастом кожа в основном включает в себя более тонкий эпидермис и дерму, что приводит к снижению устойчивости к силам сдвига и повышению восприимчивости к ранам после травм25, 26. Чтобы изучить влияние лечения MС на толщину кожи, мы провели окрашивание H&E на Ткани кожи EFT-412, которые инкубировали в культуральной среде, содержащей 0,1 мкМ, 0,5 мкМ или 2,5 мкМ MB, в течение двух недель с ежедневной заменой каждой среды. Затем были измерены поперечные срезы дермы после окрашивания гематоксилин-эозином (рис. 5А). Мы заметили, что ткани кожи, обработанные MС, имели более толстые слои дермы, чем контрольная дерма, обработанная PBS (рис. 5A и B). Количественный анализ также показал, что наибольшее увеличение толщины дермы произошло при 0,5 мкМ MB (рис. 5B). Мы также попытались проанализировать толщину рогового слоя и слоев эпидермиса в тех тканях кожи, окрашенных гематоксилин-эозином, но обнаружили, что толщина этих слоев по своей природе сильно варьируется, вероятно, из-за подготовки ткани и экспериментальной обработки.
Кожа человека удерживает воду в основном через самый внешний роговой слой. Потеря влаги в стареющей коже из-за снижения функции рогового слоя приводит к дряблости кожи и появлению морщин27, 28. Чтобы изучить влияние МС на роговой слой, мы оценили содержание воды в EFT-412. ткани кожи, инкубированные в культуральной среде с добавлением МБ в течение двух недель. В этом эксперименте определяли электрические импедансы кожных тканей и использовали их как индикаторы содержания воды. В соответствии с измерением толщины дермы мы обнаружили, что уровни гидратации кожи были значительно выше в тканях EFT-412, обработанных MB в концентрации 0,5 мкМ и 2,5 мкМ, по сравнению с контролем PBS (рис. 5C). Вместе эти эксперименты показали, что лечение MB увеличивает толщину дермы кожи и улучшает ее увлажнение.
Лечение MС изменяет экспрессию подмножества белков ECM, включая активацию эластина и коллагена 2A1.
Эластин, один из наиболее распространенных компонентов ВКМ в дерме кожи, играет важную роль в поддержании эластичности и упругости кожи. Он синтезируется и секретируется дермальными фибробластами и объединяется с другими белками ВКМ в структуры высокого порядка2, 3. Во время физиологического старения выработка эластина остается относительно стабильной до 30–40 лет, а затем резко снижается3, 29. Наше предыдущее исследование показали, что уровень мРНК эластина повышается, по крайней мере, в два раза в нормальных фибробластах, обработанных MС, по сравнению с контрольными клетками, обработанными имитацией13. Чтобы проверить, можно ли перенести этот результат из 2D-культуры фибробластов в 3D-модели кожи человека, мы экстрагировали РНК из тканей кожи EFT-412 после двухнедельной обработки MС в концентрациях 0,1, 0,5 и 2,5 мкМ. Количественный анализ RT-PCR показал, что уровни мРНК эластина были значительно повышены в тканях кожи, обработанных MС во всех трех дозах (фиг. 6A). Вестерн-блоттинг-анализ дополнительно подтвердил повышенное содержание белка эластина в тканях кожи, обработанных MС, по сравнению с контрольным носителем (фиг. 6B). Иммуногистохимия с антителом против эластина на поперечных срезах ткани EFT-412 выявила значительно больше эластиновых волокон в дерме в коже, обработанной 0,5 мкМ или 2,5 мкМ MС, и умеренное увеличение эластиновых волокон в образцах ткани, обработанных 0,1 мкМ MС ( Рис. 6С).
Чтобы дополнительно изучить, регулирует ли МВ дополнительные компоненты ВКМ, помимо эластина, мы провели скрининг генов ВКМ с использованием массива ПЦР Bio-Rad, который содержит 30 генов, которые, как известно, участвуют в ремоделировании ВКМ человека. Из этих 30 генов пять генов, включая COL2A1, IGF1, KLK3, AC002094.1 и PLG, активировались MB, а два гена, MMP9 и LAMC2, подавлялись MB в тканях EFT-412. Примечательно, что большинство этих генов продемонстрировали дозозависимый ответ на концентрацию MB (рис. 6D).
MС способствует заживлению ран в дермальных фибробластах
Кожные процессы заживления ран включают миграцию эпидермальных кератиноцитов, миграцию дермальных фибробластов и взаимодействие этих клеток с ЕСМ30. Возможности восстановления кожи снижаются с возрастом из-за структурных и функциональных изменений, таких как снижение пролиферации и миграции фибробластов и разрушение коллагена и эластина в ECM31. Основываясь на результатах рисунков 1–6, мы предполагаем, что лечение МС будет способствовать заживлению ран на коже.
Чтобы проверить эту гипотезу, мы провели анализ раны in vitro, который имитирует процесс заживления кожной раны30, 32. Монослои фибробластов ранили с помощью царапины, и изображения движения клеток в области царапин были получены через 0 и 24 часа после ранения. Были исследованы две нормальные линии фибробластов кожи, одна из которых была получена от человека среднего возраста, а другая - от человека 84 лет. Как и ожидалось, фибробласты донора среднего возраста восстанавливались быстрее, чем фибробласты старого донора (рис. 7А-С). Примечательно, что фибробласты, обработанные MС, в обеих клеточных линиях репопуляции восстанавливались значительно быстрее, чем их аналоги, обработанные носителем (рис. 7A-C), что свидетельствует о том, что лечение MС способствует заживлению ран.
Таким образом, наши анализы с использованием 2D-дермальных фибробластов и 3D-реконструированных моделей кожи подтверждают идею о том, что MB является безопасным и мощным антиоксидантом и имеет большой потенциал для использования в уходе за кожей.
Обсуждение
MС является лучшим и более безопасным поглотителем АФК, чем NAC, MitoQ и mTEM.
В нашем исследовании мы сравнили MС с тремя другими поглотителями АФК, включая широко используемый общий антиоксидант NAC и два митохондриально-специфических антиоксиданта, MitoQ и mTEM, и обнаружили, что MС был наиболее эффективным, а mTEM был следующим лучшим в снижении митохондриального АФК и стимулирующие пролиферацию клеток (рис. 1). К нашему удивлению, мы не наблюдали никаких положительных эффектов лечения NAC и даже побочных эффектов MitoQ (рис. 1). Несоответствие наших результатов с некоторыми предыдущими отчетами может быть связано с гораздо более длительным лечением NAC или MitoQ в этом исследовании, чем в предыдущих экспериментах 11, 21, 33. Как показано ранее 9, 10, 13, 14 и на рис. 4, MС был использован в клетках и животных для долгосрочных экспериментов с небольшой токсичностью или раздражением. Поэтому мы предполагаем, что MС является гораздо более безопасным и более эффективным антиоксидантом, чем NAC, MitoQ и mTEM, для длительного применения на фибробластах кожи.
Как MС снижает АФК и стимулирует пролиферацию клеток?
Мы предполагаем, что MС проявляет свои мощные антиоксидантные эффекты несколькими путями, включая блокирование выработки оксидантов10, 34, 35 и усиление антиоксидантной защиты. MС обладает многими уникальными химическими и физическими свойствами, в том числе широкой растворимостью как в воде, так и в органических растворителях (дополнительная таблица 2) и низким окислительно-восстановительным потенциалом9, 10. Эти свойства позволяют MС легко проникать через бислойные мембраны и достигать различных клеточных компартментов, таких как митохондрии и ядро, и быстро обмениваться между его окисленной формой MС и его восстановленной формой MСH2. Попадая в митохондрии, МБ действует как альтернативный переносчик электронов. Сначала он восстанавливается до MСH2 с помощью NADH-дегидрогеназы комплекса I, а затем снова окисляется до MС цитохромом с. Циклическое переключение между этими двумя формами облегчает транспорт электронов для синтеза АТФ, основной функции митохондрий9, 10. Что еще более важно, это предотвращает утечку электронов для образования оксидантов, токсичных побочных продуктов в митохондриях10. MС также улучшает функцию митохондрий, индуцируя PGC1α, центральный медиатор митохондриального биогенеза13, 35, и несколько ключевых компонентов транспортной цепи электронов (ETC), включая ЦОГ II и ЦОГ IV9, 10, 34. В целом, эти данные подтверждают, что MС способствует митохондриальной функции. и снизить продукцию АФК.
Интересно, что новые появляющиеся данные свидетельствуют о том, что MС также может влиять на центральный путь антиоксидантной защиты и другие важные функции в клетке, вероятно, за счет изменения экспрессии генов. Предыдущий анализ нейронов24 и наше исследование фибробластов кожи (рис. 3А и В) показали, что МС эффективно повышает экспрессию Nrf2. Nrf2 контролирует базальную и индуцированную экспрессию множества ARE-зависимых генов, воспринимающих оксиданты, и регулирует антиоксидантную защиту. Соответственно, мы наблюдали значительное увеличение уровня мРНК некоторых ARE-зависимых генов (рис. 3C). Ранее мы провели анализ секвенирования РНК, сравнивая профили экспрессии генов в нормальных и HGPS-фибробластах, обработанных MС и имитации13. В образцах HGPS после обработки MС (13) было идентифицировано более тысячи генов с дифференциальной экспрессией. Среди этих генов анализ Gene Ontology (GO) указывает на два значительно обогащенных кластера генов: (1) клеточный цикл и митоз и (2) реакция на повреждение ДНК и восстановление (дополнительная таблица 4). В поддержку результатов анализа GO сообщалось, что MС стимулирует сильную пролиферацию клеток и задерживает клеточное старение во многих первичных клеточных линиях 10, 13, 35. Кроме того, мы недавно показали, что лечение MС способствует восстановлению повреждений ДНК в фибробластах 36.
В целом эти данные свидетельствуют о том, что MС обладает широким спектром благотворного воздействия на клетки фибробластов, возможно, из-за его внутренних химических и физических свойств и его способности изменять экспрессию ключевых генов, участвующих в антиоксидантной защите, функции митохондрий, клеточном цикле и ДНК. пути восстановления повреждений. Необходимы дальнейшие исследования, чтобы понять, как MС изменяет экспрессию генов в клетках.
Как MС увеличивает толщину и увлажнение дермы?
Толщина кожи человека уменьшается с возрастом как в эпидермисе, так и в дерме25. Это зависящее от времени изменение обусловлено постепенным накоплением клеточных АФК, уменьшением количества клеток кожи, дефицитом коллагена и эластина и их дезорганизацией. В результате снижается прочность и эластичность кожи, что сопровождается ослаблением барьерной функции кожи и замедлением заживления ран2. Основываясь на анализе экспрессии компонентов ВКМ (рис. 6), мы подтверждаем, что увеличение толщины слоя дермы, возникающее при лечении МБ (рис. 5), по крайней мере, частично является результатом повышенной экспрессии компонентов ВКМ, например. Col2A1 и эластин, два основных структурных и функциональных белка в дерме. Кроме того, митохондриальные защитные эффекты MС могут также способствовать выработке энергии, необходимой во время пролиферации клеток и поддержания дермы27.
Одной из наиболее важных функций кожи является обеспечение барьера для защиты организма от внешних воздействий и предотвращения избыточного испарения воды. Эта барьерная функция кожи в основном обусловлена роговым слоем, который состоит из нескольких слоев мертвых корнеоцитов и является последней стадией эпидермальной дифференцировки27. Толщина рогового слоя и содержание в нем межклеточных липидов влияют на качество барьерной функции. С возрастом барьерная функция кожи снижается в основном из-за снижения содержания липидов37. Сообщалось, что MС активирует PGC1α, который является коактиватором PPARγ, одного из ключевых регуляторов адипогенеза. Кроме того, было показано, что обработка MС способствует экспрессии K1413, что может способствовать формированию плотной сети кератиновых белков в зернистом слое, тем самым предотвращая испарение воды.
Может ли лечение МС уменьшить морщины на коже?
Сморщивание кожи является одним из наиболее заметных клинических признаков стареющей кожи, которое может усугубляться воздействием солнца, дыма или обезвоживания. Молекулярные механизмы, лежащие в основе образования складок кожи, являются результатом значительного ухудшения состояния молекул кожного матрикса, т. е. уменьшения и дезорганизации коллагена и уменьшения и деформации эластических волокон1,2,3.
Коллаген является наиболее распространенным белком ECM, продуцируемым дермальными фибробластами. Коллаген типа I составляет около 80% сухой массы дермы, другие типы (II, III, IV) также встречаются в тканях кожи. Наши результаты показали дозозависимое увеличение COL2A1 на уровне транскрипции при лечении MС (рис. 6D). Мы не наблюдали изменений в коллагене I типа, вероятно, из-за его высокого содержания в ткани кожи EFT-412, реконструированной из клеток взрослого организма. ММР, разрушающие коллаген ферменты, секретируемые кератиноцитами и фибробластами, способствуют расщеплению коллагена и уменьшают синтез коллагена2. В настоящем исследовании мы обнаружили значительное ингибирование экспрессии MMP9 при лечении MС (рис. 6D), что свидетельствует об ослаблении деградации коллагена в ECM. Инсулиноподобный фактор роста 1 (IGF-1), гормон, секретируемый дермальными фибробластами и кератиноцитами, повышает экспрессию коллагена и ингибирует MMP139. Экспрессия IGF-1 снижается с возрастом40. В этой 3D-модели кожи мы показали усиление транскрипции IGF-1 при лечении MС (рис. 6D), что еще раз подтверждает идею о том, что лечение MС увеличивает коллаген в дерме. Эластин, второй по распространенности компонент внеклеточного матрикса, представляет собой волокнистый белок, составляющий 2–4% сухой массы дермы. Он обеспечивает естественную эластичность и прочность кожи человека, а также играет роль в восстановлении тканей. . Основываясь на этих результатах, мы предполагаем, что, регулируя и организуя экспрессию этих генов ECM, MС может уменьшить образование морщин на коже. Кроме того, усиленное увлажнение кожи в результате применения МС задерживает появление морщин.
Таким образом, MС в наномолярной концентрации способен удалять свободные радикалы и стимулировать пролиферацию клеток как в молодых, так и в старых дермальных фибробластах. Обработка MС на трехмерных реконструированных моделях кожи убедительно свидетельствует о его потенциале для улучшения жизнеспособности кожи, увеличения гидратации и толщины кожи, стимулирования синтеза эластина и коллагена кожи и защиты матрикса кожи за счет ингибирования ферментативной деградации MMP. В целом, наше исследование предполагает, что MС может быть многообещающим агентом для использования в антивозрастной косметике.
Anti-Aging Potentials of Methylene Blue for Human Skin Longevity
(май 2017)
Антивозрастной потенциал метиленового синего для продления жизни кожи человека
Абстракт
Окислительный стресс является основной причиной старения кожи, которое включает морщины, пигментацию и ослабленную способность к заживлению ран. Применение антиоксидантов в уходе за кожей хорошо зарекомендовало себя как эффективный подход к замедлению процесса старения кожи. Метиленовый синий (МС), традиционный антиоксидант, нацеленный на митохондрии, продемонстрировал высокую эффективность очистки от АФК в культивируемых фибробластах кожи человека, полученных от здоровых доноров и от пациентов с прогерией, генетическим заболеванием преждевременного старения. По сравнению с другими широко используемыми антиоксидантами общего и митохондриального действия мы обнаружили, что MС более эффективно стимулирует пролиферацию фибробластов кожи и замедляет клеточное старение. Тест на раздражение кожи, проведенный на трехмерной модели кожи человека, реконструированной in vitro, показал, что MС безопасен при длительном использовании и не вызывает раздражения даже при высоких концентрациях. Применение MB к этой 3D-модели кожи также продемонстрировало, что MС улучшает жизнеспособность кожи, способствует заживлению ран и увеличивает гидратацию кожи и толщину дермы. Анализ экспрессии генов показал, что лечение MС изменяет экспрессию подмножества белков внеклеточного матрикса в коже, включая активацию эластина и коллагена 2A1, двух основных компонентов здоровой кожи. В целом, наше исследование показывает, что MС обладает большим потенциалом для ухода за кожей.
Введение
Кожа – самый большой и самый видимый орган человеческого тела. Старая кожа биологически характеризуется уплощением дермально-эпидермального соединения и общей атрофией внеклеточного матрикса (ECM) с дезорганизованным и сниженным содержанием коллагена и эластина1, 2. Существует два различных типа старения кожи, внутреннее и внешнее, вызванное физиологические и экологические факторы соответственно1,2,3. Внутреннее старение кожи отражает естественные изменения кожи по мере старения и клинически проявляется в виде мелких морщин на сухой коже. Внешнее старение кожи представляет собой ускоренную форму из-за воздействия на кожу солнечного света и/или загрязнения воздуха и фенотипически проявляется в виде сухой, грубой, пигментированной и истертой кожи, особенно на лице и руках. Хотя оба типа старения кожи проявляются по-разному, они частично связаны с окислительным повреждением, вызванным свободными радикалами.
Уравновешивая производство свободных радикалов и нейтрализацию антиоксидантов, клетки обычно поддерживают низкие уровни активных форм кислорода (АФК)4. По мере старения сочетание накопления АФК и снижения способности поглощать АФК приводит к усилению окислительного стресса, что приводит к повреждению макромолекул в органах. Когда кожа регулярно подвергается стрессовым факторам окружающей среды, таким как УФ-излучение, дым и загрязняющие вещества, вырабатывается повышенное количество свободных радикалов, которые ускоряют старение кожи2. Избыток АФК снижает синтез коллагена и увеличивает расщепление коллагена за счет стимуляции экспрессии матриксной металлопротеиназы (ММП), что в конечном итоге вызывает изменения дермального матрикса5, 6. На основании этой теории АФК, эффективным подходом к замедлению старения кожи является внешнее питание. антиоксиданты через продукты по уходу за кожей, чтобы либо подавить производство, либо нейтрализовать избыток свободных радикалов6.
Метиленовый синий (МС), лекарство вековой давности, впервые синтезированное в 1876 году, использовалось в клинической медицине для лечения различных заболеваний, в т.ч. метгемоглобинемия, малярия, вазоплегия, септический шок, химиотерапия рака и болезнь Альцгеймера7,8,9. MС представляет собой диаминофенотиазин с низким окислительно-восстановительным потенциалом 11 мВ. Это свойство обеспечивает эффективную цикличность между окисленной формой MС и восстановленной формой MСH2, что облегчает транспорт электронов в митохондриях и снижает выработку митохондриального супероксида. Он также индуцирует экспрессию митохондриальных комплексов II и IV9, 10. Кроме того, MС обладает высокой проницаемостью в биологических мембранах из-за его растворимости как в воде, так и в органическом растворителе, что позволяет ему свободно проникать во внутриклеточные компартменты, такие как митохондрии, лизосомы и ядро10. ,11,12.
Недавно MС привлек внимание не только своим нейропротекторным действием при лечении болезни Альцгеймера7, 9, но и своими омолаживающими свойствами10, 13, 14. Предыдущие исследования показали, что при лечении MС нормальные фибробласты демонстрируют увеличение продолжительности жизни клеток, улучшение клеточной пролиферации и сниженной экспрессии p16, биомаркера физиологического старения9, 10. Кроме того, MС увеличивал продолжительность жизни самок мышей на 6% при включении в пищу14. Недавно мы показали, что MС в наномолярной концентрации восстанавливает аномальные ядерные и митохондриальные фенотипы, стимулирует пролиферацию клеток и замедляет старение фибробластов кожи у пациентов с синдромом прогерии Хатчинсона-Гилфорда (HGPS, прогерия), редким генетическим заболеванием ускоренного старения13.
Основываясь на этих наблюдениях, мы предполагаем, что MС может эффективно защищать кожу от окислительного стресса и замедлять старение кожи. Чтобы проверить эту идею, мы исследовали омолаживающие эффекты MС в коже человека, используя 2D первичные дермальные фибробласты и реконструировали 3D модели кожи человека.
Полученные результаты
MС является более мощным поглотителем АФК, чем NAC, MitoQ и mTEM.
Чтобы оценить эффективность MС в качестве антиоксиданта, мы сначала сравнили эффекты лечения MС с эффектами трех других популярных поглотителей АФК, в частности, N-ацетил-L-цистеина (NAC), MitoQ и MitoTEMPO (mTEM). (Дополнительные таблицы 1 и 2). NAC является широко используемым общим поглотителем АФК, который действует как предшественник синтеза глутатиона и стимулирует определенные ферменты, участвующие в регенерации глутатиона15. MitoQ представляет собой модифицированный кофермент Q10 с избирательным накоплением в митохондриях16. mTEM представляет собой митохондриально-направленный миметик супероксиддисмутазы, который обладает свойствами удаления супероксида и алкильных радикалов17, 18. Чтобы оценить эффекты каждого антиоксиданта, первичные фибробласты кожи нормального человека среднего возраста и пациента с HGPS лечили в течение 4 недель. Митохондриальные АФК (обозначенные MitoSOX), основной ресурс всех клеточных АФК, затем измеряли с помощью анализа FACS. Клетки HGPS использовались в качестве ускоренной модели нормального старения, поскольку они имеют много общих черт с физиологическим старением19 (дополнительные таблицы 1 и 2).
NAC добавляли в культуральную среду в концентрации 100 мкМ в соответствии с предыдущей публикацией20. В отличие от омолаживающих эффектов MB, длительное лечение NAC не снижало уровень митохондриальных АФК и, по-видимому, замедляло пролиферацию клеток как в нормальных, так и в HGPS-клетках (рис. 1A и B). К нашему удивлению, лечение MitoQ в дозе 100 нМ, как предполагалось в предыдущих исследованиях 16, 21, не снижало, а резко повышало уровень митохондриальных АФК (рис. 1С). Кроме того, обработка MitoQ не способствовала, а ингибировала пролиферацию клеток как в нормальных, так и в HGPS-клетках (рис. 1D). Обработка mTEM при концентрации 100 нМ показала умеренные эффекты удаления АФК на клетках HGPS (рис. 1E). Он также умеренно способствовал нормальной пролиферации клеток, но не стимулировал клетки HGPS (рис. 1F). Среди всех четырех протестированных антиоксидантов MС был наиболее эффективным в снижении митохондриальных АФК и стимулировании пролиферации клеток кожи (рис. 1A–F, дополнительная таблица 2).

МС уменьшает признаки старения в старых клетках кожи
Затем мы спросили, может ли лечение MС задержать или обратить вспять фенотипы старения из клеток кожи, полученных от пожилых людей. Две старые линии дермальных фибробластов от лиц старше 80 лет (3-OM и 4-OF) и две молодые линии фибробластов кожи от лиц моложе 30 лет (1-YM и 2-YF) были отобраны для лечения MС (дополнительная таблица 1). ). Старые фибробласты, особенно клетки 4-OF, демонстрировали тяжелые фенотипы старения. На молекулярном уровне линии 3-OM и 4-OF демонстрировали повышенные сигналы SA-β-gal и экспрессию p16, двух широко используемых биомаркеров старения, по сравнению с таковыми в молодых клетках (1-YM и 2-YF) (рис. 2А и В). Анализ FACS выявил гораздо более высокие уровни митохондриальных АФК в 3-OM и 4-OF, чем в контрольных клетках 1-YM и 2-YF (рис. 2C). Кроме того, старые клетки пролиферировали намного медленнее, чем молодые клетки (рис. 2D, сплошные линии). В частности, клетки 4-OF прекратили рост к концу эксперимента на 18-м пассаже (рис. 2D).
После выращивания клеток в культуральной среде с добавлением 100 нМ MС в течение четырех недель стало очевидно, что связанные со старением фенотипы значительно уменьшились в старых клеточных линиях 3-OM и 4-OF. Обработка MС эффективно снижала сигналы SA-β-gal и снижала экспрессию p16 в клетках 3-OM и 4-OF (рис. 2A и B). Кроме того, обработка MС снижала повышенный уровень MitoSOX в старых клеточных линиях, особенно в линии 3-OM, до уровня, сравнимого с таковым в молодых клетках (рис. 2C). Кроме того, анализ кривой роста показал, что все клеточные линии (как молодые, так и старые) лучше пролиферировали в клеточной среде с добавлением MС (пунктирные линии, рис. 2D). В совокупности эти результаты показали, что лечение MС способно уменьшать и/или обращать вспять фенотипы старения в старых фибробластах кожи.
MС повышает экспрессию Nrf2 и нижестоящих антиоксидантных генов.
Ядерный фактор, связанный с эритроидом 2, фактор 2 (Nrf2), известен как важный регулятор системы антиоксидантной защиты, индуцирующий экспрессию множества генов, содержащих элементы антиоксидантного ответа (ARE), тем самым снижая общий клеточный ROS22. Недавнее исследование показало, что антиоксидантный путь Nrf2 является движущим механизмом HGPS23. Важно отметить, что МС, как было показано, активирует Nrf2 в нейронах24.
Мы предполагаем, что MС может активировать опосредованный Nrf2 антиоксидантный ответ, тем самым моделируя тушение АФК в фибробластах кожи. Чтобы проверить эту идею, мы сначала изучили экспрессию Nrf2 во всех шести линиях дермальных фибробластов человека, использованных в исследованиях рис. 1 и 2. Вестерн-блоттинг подтвердил повышенное количество белка Nrf2 в большинстве клеточных линий, обработанных MB, по сравнению с контрольным носителем (рис. 3А и В). Старая клетка 3-OM не показала явного увеличения белка Nrf2 при обработке MB, вероятно, из-за ее крайней стадии старения клеток, что ограничивает количество клеток для анализа. Затем мы исследовали уровни мРНК генов, содержащих ARE, расположенных ниже по течению Nrf2, в линии фибробластов HGPS, где наблюдалось наиболее значительное увеличение белка Nrf2 при обработке MС. Количественный анализ RT-PCR выявил значительное увеличение экспрессии мРНК подмножества ARE-содержащих генов, включая GCLC, GSR, GPX7, GSTM1 и TBP (рис. 3C). Вместе эти анализы подтверждают идею о том, что MС регулирует клеточные уровни ROS, по крайней мере частично, путем активации Nrf2-опосредованного антиоксидантного ответа.
MС повышает жизнеспособность тканей и не вызывает раздражения на реконструированной in vitro трехмерной коже человека.
Основываясь на потенциале MС как мощного антиоксиданта в 2D-линиях фибробластов, мы затем исследовали влияние MС на 3D-реконструкцию эпидермиса кожи человека. Мы использовали две доступные модели кожи: модель кожи EpiDerm EPI-200 (рис. 4A, верхняя панель) и модель кожи полной толщины EpiDerm EFT-412 (рис. 4A, нижняя панель). Эти модели кожи in vitro состоят из нормальных эпидермальных кератиноцитов и фибробластов человеческого происхождения, культивируемых на поверхности раздела воздух-жидкость на полупроницаемой вставке для тканевых культур (рис. 4B, подробности описаны в разделе «Материалы и методы»), которые имитируют нормальный эпидермис кожи человека и используются в качестве одобренной замены кроликов Дрейза для теста на раздражение кожи in vitro (SIT)18.
Во-первых, мы оценили безопасность МБ, проведя SIT на модели EPI-200. Раздражение кожи характеризуется обратимой местной воспалительной реакцией, и анализ жизнеспособности клеток МТТ используется для оценки повреждения, вызванного исследуемым раздражителем. Снижение МТТ более чем на 50% указывало на раздражение кожи, как показано в положительном контроле (5% SDS, рис. 4C). МБ тестировали в широком диапазоне концентраций от 0,2 мкМ до 500 мкМ. Ни одна из этих дозировок существенно не влияла на жизнеспособность клеток при местном воздействии в течение 60 минут (рис. 4С).
Чтобы дополнительно проверить потенциальное раздражение MB после длительного применения на коже, мы добавили MB в различных концентрациях в культуральную среду и инкубировали полнослойную модель кожи EFT-412 в этих средах в общей сложности в течение двух недель. На 14-й день проводили анализ МТТ. В течение этого двухнедельного инкубационного периода мы заметили, что ткани кожи, обработанные высокими концентрациями MB (5,0 мкМ и выше), начали казаться синими через 3 дня, что позволяет предположить, что дозировка MB должна быть ограничена, чтобы избежать его побочного окрашивающего эффекта на внешний вид кожи. . В тканях, обработанных более низкими концентрациями MB (от 0,1 мкМ до 2,5 мкМ), не было никакого окрашивания тканей. В соответствии со способностью MB стимулировать пролиферацию клеток, мы заметили, что в дозе 0,5 мкМ MB значительно увеличивает жизнеспособность клеток по сравнению с контролем PBS. Кроме того, ткани, обработанные более высокими концентрациями MB (5,0 мкМ и 10,0 мкМ), показали снижение жизнеспособности клеток (рис. 4D). На основании этих результатов можно сделать вывод, что низкие концентрации МС (менее 2,5 мкМ) не раздражают и не окрашивают кожу и поэтому безопасны для длительного использования. В результате мы провели последующие исследования с MB в концентрациях ниже 2,5 мкМ.
MС увеличивает толщину кожи и увлажнение
Толщина кожи человека уменьшается в среднем на 6% за десятилетие25. Постепенно истончающаяся с возрастом кожа в основном включает в себя более тонкий эпидермис и дерму, что приводит к снижению устойчивости к силам сдвига и повышению восприимчивости к ранам после травм25, 26. Чтобы изучить влияние лечения MС на толщину кожи, мы провели окрашивание H&E на Ткани кожи EFT-412, которые инкубировали в культуральной среде, содержащей 0,1 мкМ, 0,5 мкМ или 2,5 мкМ MB, в течение двух недель с ежедневной заменой каждой среды. Затем были измерены поперечные срезы дермы после окрашивания гематоксилин-эозином (рис. 5А). Мы заметили, что ткани кожи, обработанные MС, имели более толстые слои дермы, чем контрольная дерма, обработанная PBS (рис. 5A и B). Количественный анализ также показал, что наибольшее увеличение толщины дермы произошло при 0,5 мкМ MB (рис. 5B). Мы также попытались проанализировать толщину рогового слоя и слоев эпидермиса в тех тканях кожи, окрашенных гематоксилин-эозином, но обнаружили, что толщина этих слоев по своей природе сильно варьируется, вероятно, из-за подготовки ткани и экспериментальной обработки.
Кожа человека удерживает воду в основном через самый внешний роговой слой. Потеря влаги в стареющей коже из-за снижения функции рогового слоя приводит к дряблости кожи и появлению морщин27, 28. Чтобы изучить влияние МС на роговой слой, мы оценили содержание воды в EFT-412. ткани кожи, инкубированные в культуральной среде с добавлением МБ в течение двух недель. В этом эксперименте определяли электрические импедансы кожных тканей и использовали их как индикаторы содержания воды. В соответствии с измерением толщины дермы мы обнаружили, что уровни гидратации кожи были значительно выше в тканях EFT-412, обработанных MB в концентрации 0,5 мкМ и 2,5 мкМ, по сравнению с контролем PBS (рис. 5C). Вместе эти эксперименты показали, что лечение MB увеличивает толщину дермы кожи и улучшает ее увлажнение.
Лечение MС изменяет экспрессию подмножества белков ECM, включая активацию эластина и коллагена 2A1.
Эластин, один из наиболее распространенных компонентов ВКМ в дерме кожи, играет важную роль в поддержании эластичности и упругости кожи. Он синтезируется и секретируется дермальными фибробластами и объединяется с другими белками ВКМ в структуры высокого порядка2, 3. Во время физиологического старения выработка эластина остается относительно стабильной до 30–40 лет, а затем резко снижается3, 29. Наше предыдущее исследование показали, что уровень мРНК эластина повышается, по крайней мере, в два раза в нормальных фибробластах, обработанных MС, по сравнению с контрольными клетками, обработанными имитацией13. Чтобы проверить, можно ли перенести этот результат из 2D-культуры фибробластов в 3D-модели кожи человека, мы экстрагировали РНК из тканей кожи EFT-412 после двухнедельной обработки MС в концентрациях 0,1, 0,5 и 2,5 мкМ. Количественный анализ RT-PCR показал, что уровни мРНК эластина были значительно повышены в тканях кожи, обработанных MС во всех трех дозах (фиг. 6A). Вестерн-блоттинг-анализ дополнительно подтвердил повышенное содержание белка эластина в тканях кожи, обработанных MС, по сравнению с контрольным носителем (фиг. 6B). Иммуногистохимия с антителом против эластина на поперечных срезах ткани EFT-412 выявила значительно больше эластиновых волокон в дерме в коже, обработанной 0,5 мкМ или 2,5 мкМ MС, и умеренное увеличение эластиновых волокон в образцах ткани, обработанных 0,1 мкМ MС ( Рис. 6С).
Чтобы дополнительно изучить, регулирует ли МВ дополнительные компоненты ВКМ, помимо эластина, мы провели скрининг генов ВКМ с использованием массива ПЦР Bio-Rad, который содержит 30 генов, которые, как известно, участвуют в ремоделировании ВКМ человека. Из этих 30 генов пять генов, включая COL2A1, IGF1, KLK3, AC002094.1 и PLG, активировались MB, а два гена, MMP9 и LAMC2, подавлялись MB в тканях EFT-412. Примечательно, что большинство этих генов продемонстрировали дозозависимый ответ на концентрацию MB (рис. 6D).
MС способствует заживлению ран в дермальных фибробластах
Кожные процессы заживления ран включают миграцию эпидермальных кератиноцитов, миграцию дермальных фибробластов и взаимодействие этих клеток с ЕСМ30. Возможности восстановления кожи снижаются с возрастом из-за структурных и функциональных изменений, таких как снижение пролиферации и миграции фибробластов и разрушение коллагена и эластина в ECM31. Основываясь на результатах рисунков 1–6, мы предполагаем, что лечение МС будет способствовать заживлению ран на коже.
Чтобы проверить эту гипотезу, мы провели анализ раны in vitro, который имитирует процесс заживления кожной раны30, 32. Монослои фибробластов ранили с помощью царапины, и изображения движения клеток в области царапин были получены через 0 и 24 часа после ранения. Были исследованы две нормальные линии фибробластов кожи, одна из которых была получена от человека среднего возраста, а другая - от человека 84 лет. Как и ожидалось, фибробласты донора среднего возраста восстанавливались быстрее, чем фибробласты старого донора (рис. 7А-С). Примечательно, что фибробласты, обработанные MС, в обеих клеточных линиях репопуляции восстанавливались значительно быстрее, чем их аналоги, обработанные носителем (рис. 7A-C), что свидетельствует о том, что лечение MС способствует заживлению ран.
Таким образом, наши анализы с использованием 2D-дермальных фибробластов и 3D-реконструированных моделей кожи подтверждают идею о том, что MB является безопасным и мощным антиоксидантом и имеет большой потенциал для использования в уходе за кожей.
Обсуждение
MС является лучшим и более безопасным поглотителем АФК, чем NAC, MitoQ и mTEM.
В нашем исследовании мы сравнили MС с тремя другими поглотителями АФК, включая широко используемый общий антиоксидант NAC и два митохондриально-специфических антиоксиданта, MitoQ и mTEM, и обнаружили, что MС был наиболее эффективным, а mTEM был следующим лучшим в снижении митохондриального АФК и стимулирующие пролиферацию клеток (рис. 1). К нашему удивлению, мы не наблюдали никаких положительных эффектов лечения NAC и даже побочных эффектов MitoQ (рис. 1). Несоответствие наших результатов с некоторыми предыдущими отчетами может быть связано с гораздо более длительным лечением NAC или MitoQ в этом исследовании, чем в предыдущих экспериментах 11, 21, 33. Как показано ранее 9, 10, 13, 14 и на рис. 4, MС был использован в клетках и животных для долгосрочных экспериментов с небольшой токсичностью или раздражением. Поэтому мы предполагаем, что MС является гораздо более безопасным и более эффективным антиоксидантом, чем NAC, MitoQ и mTEM, для длительного применения на фибробластах кожи.
Как MС снижает АФК и стимулирует пролиферацию клеток?
Мы предполагаем, что MС проявляет свои мощные антиоксидантные эффекты несколькими путями, включая блокирование выработки оксидантов10, 34, 35 и усиление антиоксидантной защиты. MС обладает многими уникальными химическими и физическими свойствами, в том числе широкой растворимостью как в воде, так и в органических растворителях (дополнительная таблица 2) и низким окислительно-восстановительным потенциалом9, 10. Эти свойства позволяют MС легко проникать через бислойные мембраны и достигать различных клеточных компартментов, таких как митохондрии и ядро, и быстро обмениваться между его окисленной формой MС и его восстановленной формой MСH2. Попадая в митохондрии, МБ действует как альтернативный переносчик электронов. Сначала он восстанавливается до MСH2 с помощью NADH-дегидрогеназы комплекса I, а затем снова окисляется до MС цитохромом с. Циклическое переключение между этими двумя формами облегчает транспорт электронов для синтеза АТФ, основной функции митохондрий9, 10. Что еще более важно, это предотвращает утечку электронов для образования оксидантов, токсичных побочных продуктов в митохондриях10. MС также улучшает функцию митохондрий, индуцируя PGC1α, центральный медиатор митохондриального биогенеза13, 35, и несколько ключевых компонентов транспортной цепи электронов (ETC), включая ЦОГ II и ЦОГ IV9, 10, 34. В целом, эти данные подтверждают, что MС способствует митохондриальной функции. и снизить продукцию АФК.
Интересно, что новые появляющиеся данные свидетельствуют о том, что MС также может влиять на центральный путь антиоксидантной защиты и другие важные функции в клетке, вероятно, за счет изменения экспрессии генов. Предыдущий анализ нейронов24 и наше исследование фибробластов кожи (рис. 3А и В) показали, что МС эффективно повышает экспрессию Nrf2. Nrf2 контролирует базальную и индуцированную экспрессию множества ARE-зависимых генов, воспринимающих оксиданты, и регулирует антиоксидантную защиту. Соответственно, мы наблюдали значительное увеличение уровня мРНК некоторых ARE-зависимых генов (рис. 3C). Ранее мы провели анализ секвенирования РНК, сравнивая профили экспрессии генов в нормальных и HGPS-фибробластах, обработанных MС и имитации13. В образцах HGPS после обработки MС (13) было идентифицировано более тысячи генов с дифференциальной экспрессией. Среди этих генов анализ Gene Ontology (GO) указывает на два значительно обогащенных кластера генов: (1) клеточный цикл и митоз и (2) реакция на повреждение ДНК и восстановление (дополнительная таблица 4). В поддержку результатов анализа GO сообщалось, что MС стимулирует сильную пролиферацию клеток и задерживает клеточное старение во многих первичных клеточных линиях 10, 13, 35. Кроме того, мы недавно показали, что лечение MС способствует восстановлению повреждений ДНК в фибробластах 36.
В целом эти данные свидетельствуют о том, что MС обладает широким спектром благотворного воздействия на клетки фибробластов, возможно, из-за его внутренних химических и физических свойств и его способности изменять экспрессию ключевых генов, участвующих в антиоксидантной защите, функции митохондрий, клеточном цикле и ДНК. пути восстановления повреждений. Необходимы дальнейшие исследования, чтобы понять, как MС изменяет экспрессию генов в клетках.
Как MС увеличивает толщину и увлажнение дермы?
Толщина кожи человека уменьшается с возрастом как в эпидермисе, так и в дерме25. Это зависящее от времени изменение обусловлено постепенным накоплением клеточных АФК, уменьшением количества клеток кожи, дефицитом коллагена и эластина и их дезорганизацией. В результате снижается прочность и эластичность кожи, что сопровождается ослаблением барьерной функции кожи и замедлением заживления ран2. Основываясь на анализе экспрессии компонентов ВКМ (рис. 6), мы подтверждаем, что увеличение толщины слоя дермы, возникающее при лечении МБ (рис. 5), по крайней мере, частично является результатом повышенной экспрессии компонентов ВКМ, например. Col2A1 и эластин, два основных структурных и функциональных белка в дерме. Кроме того, митохондриальные защитные эффекты MС могут также способствовать выработке энергии, необходимой во время пролиферации клеток и поддержания дермы27.
Одной из наиболее важных функций кожи является обеспечение барьера для защиты организма от внешних воздействий и предотвращения избыточного испарения воды. Эта барьерная функция кожи в основном обусловлена роговым слоем, который состоит из нескольких слоев мертвых корнеоцитов и является последней стадией эпидермальной дифференцировки27. Толщина рогового слоя и содержание в нем межклеточных липидов влияют на качество барьерной функции. С возрастом барьерная функция кожи снижается в основном из-за снижения содержания липидов37. Сообщалось, что MС активирует PGC1α, который является коактиватором PPARγ, одного из ключевых регуляторов адипогенеза. Кроме того, было показано, что обработка MС способствует экспрессии K1413, что может способствовать формированию плотной сети кератиновых белков в зернистом слое, тем самым предотвращая испарение воды.
Может ли лечение МС уменьшить морщины на коже?
Сморщивание кожи является одним из наиболее заметных клинических признаков стареющей кожи, которое может усугубляться воздействием солнца, дыма или обезвоживания. Молекулярные механизмы, лежащие в основе образования складок кожи, являются результатом значительного ухудшения состояния молекул кожного матрикса, т. е. уменьшения и дезорганизации коллагена и уменьшения и деформации эластических волокон1,2,3.
Коллаген является наиболее распространенным белком ECM, продуцируемым дермальными фибробластами. Коллаген типа I составляет около 80% сухой массы дермы, другие типы (II, III, IV) также встречаются в тканях кожи. Наши результаты показали дозозависимое увеличение COL2A1 на уровне транскрипции при лечении MС (рис. 6D). Мы не наблюдали изменений в коллагене I типа, вероятно, из-за его высокого содержания в ткани кожи EFT-412, реконструированной из клеток взрослого организма. ММР, разрушающие коллаген ферменты, секретируемые кератиноцитами и фибробластами, способствуют расщеплению коллагена и уменьшают синтез коллагена2. В настоящем исследовании мы обнаружили значительное ингибирование экспрессии MMP9 при лечении MС (рис. 6D), что свидетельствует об ослаблении деградации коллагена в ECM. Инсулиноподобный фактор роста 1 (IGF-1), гормон, секретируемый дермальными фибробластами и кератиноцитами, повышает экспрессию коллагена и ингибирует MMP139. Экспрессия IGF-1 снижается с возрастом40. В этой 3D-модели кожи мы показали усиление транскрипции IGF-1 при лечении MС (рис. 6D), что еще раз подтверждает идею о том, что лечение MС увеличивает коллаген в дерме. Эластин, второй по распространенности компонент внеклеточного матрикса, представляет собой волокнистый белок, составляющий 2–4% сухой массы дермы. Он обеспечивает естественную эластичность и прочность кожи человека, а также играет роль в восстановлении тканей. . Основываясь на этих результатах, мы предполагаем, что, регулируя и организуя экспрессию этих генов ECM, MС может уменьшить образование морщин на коже. Кроме того, усиленное увлажнение кожи в результате применения МС задерживает появление морщин.
Таким образом, MС в наномолярной концентрации способен удалять свободные радикалы и стимулировать пролиферацию клеток как в молодых, так и в старых дермальных фибробластах. Обработка MС на трехмерных реконструированных моделях кожи убедительно свидетельствует о его потенциале для улучшения жизнеспособности кожи, увеличения гидратации и толщины кожи, стимулирования синтеза эластина и коллагена кожи и защиты матрикса кожи за счет ингибирования ферментативной деградации MMP. В целом, наше исследование предполагает, что MС может быть многообещающим агентом для использования в антивозрастной косметике.
- Лариса
- Богиня Муми-Дола
- Сообщения: 4520
- Зарегистрирован: Чт 20 авг 2009, 21:48
- Откуда: Мексика
Re: Метиленовый синий (синька)
Елена25
Интересно, спасибо!
Попробовать что ли в крем добавлять? Будет так работать, как Вы думаете?
Интересно, спасибо!
Попробовать что ли в крем добавлять? Будет так работать, как Вы думаете?
Владис 13.02.2010
- Жуженька
- Богиня Муми-Дола
- Сообщения: 16440
- Зарегистрирован: Сб 08 авг 2009, 17:55
Re: Метиленовый синий (синька)
Это краситель, не отстирывается
Сообщений: 43
• Страница 1 из 3 • 1, 2, 3
Вернуться в Питание и здоровый образ жизни
Кто сейчас на конференции
Сейчас этот форум просматривают: нет зарегистрированных пользователей и гости: 2